题目内容
(11分)化学兴趣小组设计以下实验方案,测定已部分变质的某小苏打样品中Na2CO3的质量分数。
[方案一]称取一定质量样品,置于坩埚中加热至恒重后,冷却,称量剩余固体质量,计算。
(1)坩埚中发生反应的化学方程式为:
________________________________________________________________________。
(2)实验中需加热至恒重的目的是:
________________________________________________________________________。
(3)实验中确定加热至恒重的方法是:
________________________________________________________________________。
(4)若加热过程中坩埚内有晶体迸溅出来,则测得的结果________(填“偏大”、“偏小”或“不变”)。
[方案二]称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量Ba(OH)2溶液,过滤,洗涤,干燥沉淀,称量固体质量,计算。(已知:Ba2++OH-+HCO3-===BaCO3↓+H2O)
(1)过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为______________。
(2)实验中判断沉淀是否完全的方法是
________________________________________________________________________________________________________________________________________。
(3)实验中洗涤沉淀的操作是
________________________________________________________________________。
(4)实验中判断沉淀是否洗涤干净的方法是
_______________________________________________________________________________________________________________________________________________。
[方案三]
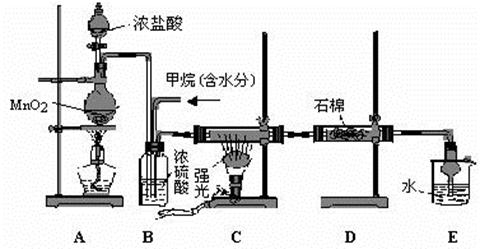
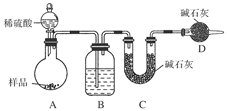
按如图所示装置进行实验:
(1)B装置内所盛试剂是________;D装置的作用是______________;分液漏斗中________(填“能”或“不能”)用盐酸代替稀硫酸进行实验。
(2)实验前称取17.9 g样品,实验后测得C装置增重8.8 g,则样品中Na2CO3的质量分数为________。
(3)根据此实验测得的数据,测定结果有误差,因为实验装置还存在一个明显缺陷是:____________________。
[方案一](1)2NaHCO3Na2CO3+CO2↑+H2O
(2)保证NaHCO3分解完全
(3)两次称量固体的质量相同'(4)偏小
[方案二](1)玻璃棒'(2)取少量上层清液于试管中,滴加一滴Ba(OH)2溶液,观察是否有白色沉淀生成
(3)向漏斗里加入蒸馏水,使水面没过沉淀物,等水过滤完后,重复操作数次
(4)取少量洗涤沉淀后的滤液于试管中,滴加一滴Na2SO4溶液,观察是否有白色沉淀生成
[方案三](1)浓H2SO4'防止空气中的水蒸气、CO2进入C装置'不能
(2)29.6%'(3)缺少一套将A、B装置内的CO2气体全部驱赶到C装置中的装置(或其他合理答案)
【解析】略