题目内容
4.将16.8LSO2气体(标准状况下)通入1.00L1.00mol•L-1的NaOH溶液中,所得产物中Na2SO3和NaHSO3的物质的量分别为( )| A. | 0mol,1mol | B. | 0.5mol,0mol | C. | 0.25mol,.0.5mol | D. | 0.25mol,0.25mol |
分析 标准状况下16.8LSO2气体的物质的量为$\frac{16.8L}{22.4L/mol}$=0.75mol,通入1.00L1.00mol/L的NaOH溶液中,反应生成Na2SO3和NaHSO3,根据元素守恒计算二者的物质的量.
解答 解:标准状况下16.8LSO2气体的物质的量为$\frac{16.8L}{22.4L/mol}$=0.75mol,通入1.00L1.00mol•L-1的NaOH溶液中,反应生成Na2SO3和NaHSO3,设产生xmolNa2SO3和ymolNaHSO3,根据Na元素守恒:2x+y=1,根据S元素守恒:x+y=0.75,联立方程$\left\{\begin{array}{l}{2x+y=1}\\{x+y=0.75}\end{array}\right.$,解得$\left\{\begin{array}{l}{x=0.25}\\{y=0.5}\end{array}\right.$,则所得产物中有0.25molNa2SO3和0.5molNaHSO3,故选C.
点评 本题主要考查混合物含量的计算,注意元素守恒思想的运用在混合物反应中的应用,可以方便解题,需要牢牢把握守恒思想,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.下列离子或分子能够在指定的分散系中大量共存的是( )
| A. | 空气中:SO2、NO、N2、NH3 | |
| B. | 明矾溶液中:Na+、K+、CH3COO-、HCO3- | |
| C. | 过量铁与稀硫酸反应后的溶液中:[Fe(CN)6]3-、NH4+、Cl-、NO3- | |
| D. | 常温下,水电离出的c(H+)=1×10-12mol/L的溶液中:Ba2+、Na+、Cl-、NO3- |
15.在恒温恒容条件下,能使A(g)+2B(g)?C(g)+D(g)正反应速率增大的措施是( )
| A. | 减小C 的浓度 | B. | 通入He气使压强增大 | ||
| C. | 减小B的浓度 | D. | 增大A或B的浓度 |
12.把a mol H2和b mol C2H4混合,在一定条件下使它们一部分发生反应生成w molC2H6,将反应混合气体完全燃烧,余下的C2H4消耗氧气的物质的量为( )
| A. | a+3b | B. | $\frac{a}{2}$+3b | C. | $\frac{a}{2}$+3b+$\frac{7}{2}$ w | D. | 3(b-w) |
19.甲醛与单烯烃的混合物中含氧的质量分数为X,则其含碳的质量分数是( )
| A. | $\frac{6(1-x)}{7}$ | B. | $\frac{1-Χ}{7}$ | C. | $\frac{3Χ}{4}$ | D. | 无法计算 |
16.下列离子方程式书写正确的是( )
| A. | 铝粉投入到NaOH溶液中:Al+3OH-═Al(OH)3↓ | |
| B. | 金属钠投入到水中:Na+H2O═Na++OH-+H2↑ | |
| C. | FeCl2溶液中滴加氨水:Fe2++2OH-═Fe(OH)2↓ | |
| D. | 碳酸钡与稀盐酸反应:BaCO3+2H+═Ba2++H2O+CO2↑ |
13.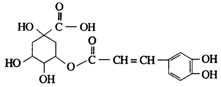 金银花中含有绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如图所示,下列有关绿原酸的说法不正确的是( )
金银花中含有绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如图所示,下列有关绿原酸的说法不正确的是( )
 金银花中含有绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如图所示,下列有关绿原酸的说法不正确的是( )
金银花中含有绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如图所示,下列有关绿原酸的说法不正确的是( )| A. | 绿原酸的分子式为C16H8O9 | |
| B. | 1个绿原酸分子中含有4个手性碳原子 | |
| C. | 1mol绿原酸最多与4molNaOH反应 | |
| D. | 1mol绿原酸最多能与6molH2发生反应 |
14.下列分散系能产生“丁达尔效应”的是( )
| A. | 苏打水溶液 | B. | 苯酚浊液 | C. | 碘化银胶体 | D. | 氯化钡溶液 |