题目内容
下列液体均处于25℃,有关叙述不正确的是( )
| A、pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 |
| B、某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐 |
| C、AgCl在同浓度的CaCl2和NaCl溶液中的溶解度不相同 |
| D、pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)<c(CH3COO-) |
考点:pH的简单计算
专题:电离平衡与溶液的pH专题
分析:A.c(H+)=-lg10-pH;
B.如果溶液的pH<7,说明溶液呈酸性,氢离子可能是酸和强酸酸式盐电离,也可能是强酸弱碱盐水解;
C.温度一定,氯化银的溶度积一定,根据氯离子浓度确定氯化银的溶解度;
D.根据电荷守恒分析.
B.如果溶液的pH<7,说明溶液呈酸性,氢离子可能是酸和强酸酸式盐电离,也可能是强酸弱碱盐水解;
C.温度一定,氯化银的溶度积一定,根据氯离子浓度确定氯化银的溶解度;
D.根据电荷守恒分析.
解答:
解:A.c(H+)=-lg10-pH,所以pH=4.5的番茄汁中c(H+)与pH=6.5的牛奶中c(H+)之比=
=100,故A正确;
B.某物质的溶液pH<7,则该物质还可能是硫酸氢盐,如硫酸氢钠溶液的pH<7,故B错误;
C.温度一定,氯化银的溶度积一定,氯离子浓度越大,氯化银的溶解度越小,同浓度的氯化钙和氯化钠溶液中,氯化钙中的氯离子浓度是氯化钠中氯离子浓度的2倍,所以氯化银在同浓度的CaCl2小于在NaCl溶液中的溶解度,故C正确;
D.CH3COOH与CH3COONa混合溶液呈酸性,则c(H+)>c(OH-),因为c(Na+)+c(H+)=c(CH3COO-)+c(HO-),所以c(Na+)<c(CH3COO-),故D正确;
故选B.
| -lg10-4.5 |
| -lg10-6.5 |
B.某物质的溶液pH<7,则该物质还可能是硫酸氢盐,如硫酸氢钠溶液的pH<7,故B错误;
C.温度一定,氯化银的溶度积一定,氯离子浓度越大,氯化银的溶解度越小,同浓度的氯化钙和氯化钠溶液中,氯化钙中的氯离子浓度是氯化钠中氯离子浓度的2倍,所以氯化银在同浓度的CaCl2小于在NaCl溶液中的溶解度,故C正确;
D.CH3COOH与CH3COONa混合溶液呈酸性,则c(H+)>c(OH-),因为c(Na+)+c(H+)=c(CH3COO-)+c(HO-),所以c(Na+)<c(CH3COO-),故D正确;
故选B.
点评:本题考查弱电解质电离和盐类水解,易错选项是B,注意强酸的酸式盐溶液也呈酸性,为易错点.

练习册系列答案
相关题目
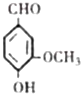 香兰素结构简式如图所示.它有宜人的气味,存在于香草、安息香和香茅油中,是制作巧克力的辅助原料.下列关于香兰素的叙述不正确的是( )
香兰素结构简式如图所示.它有宜人的气味,存在于香草、安息香和香茅油中,是制作巧克力的辅助原料.下列关于香兰素的叙述不正确的是( )| A、香兰素的分子式是C8H8O3 |
| B、它可以和NaOH溶液反应 |
| C、它可以发生银镜反应 |
| D、它可以发生水解反应 |
分类是化学学习和研究的常用手段.下列分类依据和结论都正确的是( )
| A、HNO3、浓硫酸都具有强氧化性,都是氧化性酸 |
| B、H2O、CH3COOH、CaCO3均含有氧元素,都是氧化物 |
| C、HCl、CH3COOH、CH3CH2OH都易溶于水,都是电解质 |
| D、HCOOH、H2CO3、H2SO4分子中均含有两个氢原子,都是二元酸 |
下列结构式从成键情况看不合理的是( )
A、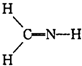 |
B、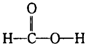 |
C、 |
D、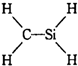 |
常温下某氨水的pH=X,某盐酸的pH=Y,已知X+Y=14,将上述氨水与盐酸等体积混合后,所得溶液中各种离子浓度的关系正确的是( )
| A、c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| B、c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| C、c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D、c(NH4+)+c(H+)═c(Cl-)+c(OH-) |
下列判断不正确的是( )
| A、非金属性:F>O>S |
| B、稳定性:SiH4>PH3>H2S |
| C、酸性:HClO4>H2SO4>H3PO4 |
| D、碱性:NaOH>Mg(OH)2>Al(OH)3 |
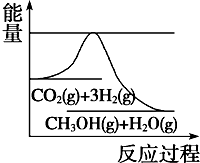 煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.