题目内容
今有Fe和Zn的混合物12.1g,与足量的稀盐酸反应,共放出H2 4.48L(标准状况).求:
(1)原混合物中Fe的质量分数.
(2)消耗HCl的物质的量.
解:n(H2)=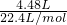 =0.2mol,设混合物中含有xmolFe,ymolZn,
=0.2mol,设混合物中含有xmolFe,ymolZn,
反应方程式为:Fe+2HCl=FeCl2+H2↑,Zn+2HCl=ZnCl2+H2↑,则
Fe+2HCl=FeCl2+H2↑
1 2 1
x 2x x
Zn+2HCl=ZnCl2+H2↑
1 2 1
y 2y y
(1)有以上反应方程式可得:
解之得: ,
,
m(Fe)=0.1mol×56g/mol=5.6g,
w(Fe)= =46.3%,
=46.3%,
答:原混合物中Fe的质量分数为46.3%.
(2)消耗盐酸的物质的量为金属物质的量的2倍,则
n(HCl)=(2x+2y)mol=(0.1×2+0.1×2)mol=0.4mol,
答:消耗HCl的物质的量为0.4mol.
分析:反应方程式为:Fe+2HCl=FeCl2+H2↑,Zn+2HCl=ZnCl2+H2↑,根据方程式计算.
点评:本题考查混合物的计算,题目难度不大,注意反应方程式的书写,根据方程式计算.
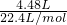 =0.2mol,设混合物中含有xmolFe,ymolZn,
=0.2mol,设混合物中含有xmolFe,ymolZn,反应方程式为:Fe+2HCl=FeCl2+H2↑,Zn+2HCl=ZnCl2+H2↑,则
Fe+2HCl=FeCl2+H2↑
1 2 1
x 2x x
Zn+2HCl=ZnCl2+H2↑
1 2 1
y 2y y
(1)有以上反应方程式可得:

解之得:
 ,
,m(Fe)=0.1mol×56g/mol=5.6g,
w(Fe)=
 =46.3%,
=46.3%,答:原混合物中Fe的质量分数为46.3%.
(2)消耗盐酸的物质的量为金属物质的量的2倍,则
n(HCl)=(2x+2y)mol=(0.1×2+0.1×2)mol=0.4mol,
答:消耗HCl的物质的量为0.4mol.
分析:反应方程式为:Fe+2HCl=FeCl2+H2↑,Zn+2HCl=ZnCl2+H2↑,根据方程式计算.
点评:本题考查混合物的计算,题目难度不大,注意反应方程式的书写,根据方程式计算.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目