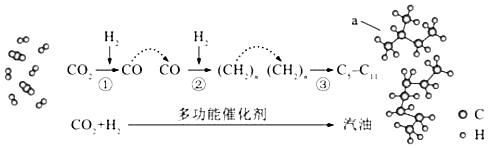
题目内容
【题目】某强酸性溶液X,可能含有Al3+、Ba2+、NH4+、Fe2+、Fe3+、CO32﹣、SO42﹣、SiO32﹣、NO3﹣中的一种或几种离子,取该溶液进行实验,其现象及转化如图.反应过程中有一种气体是红棕色. 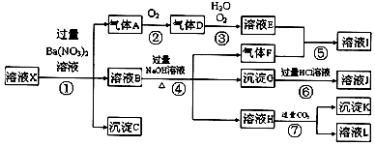
请回答下列问题:
(1)产生气体A的离子方程式为;
(2)若转化③中,D、H2O、O2三种物质恰好发生化合反应生成E,则反应中D与O2的物质的量之比为;
(3)转化⑦中的离子方程式为;
(4)溶液X中,关于NO3﹣的判断一定正确的是
a.一定有 b.一定没有 c.可能有.
【答案】
(1)3Fe2++NO3﹣+4H+=3Fe3++NO+2H2O
(2)1:4
(3)2H2O+AlO2﹣+CO2=Al(OH)3+HCO3﹣
(4)b
【解析】解:(1)A为NO,产生气体A的离子方程式为3Fe2++NO3﹣+4H+=3Fe3++NO+2H2O,所以答案是:3Fe2++NO3﹣+4H+=3Fe3++NO+2H2O;(2)若转化③中,D、H2O、O2三种物质恰好发生化合反应生成E,发生4NO2+O2+4H2O=4HNO3 , 则反应中O2与D的物质的量之比为1:4,所以答案是:1:4;(3)转化⑦中的离子方程式为2H2O+AlO2﹣+CO2=Al(OH)3+HCO3﹣ , 所以答案是:2H2O+AlO2﹣+CO2=Al(OH)3+HCO3﹣;(4)溶液中Fe2+和NO3﹣不能共存,加入硝酸钡产生气体,则溶液中存在Fe2+ , 不存在NO3﹣ , 只有b符合,所以答案是:b.

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案【题目】一定温度下,在三个体积约为1.0L的恒容密闭容器中发生反应:2CH3OH(g)═CH3OCH3(g)+H2O(g)
下列说法正确的是( )
容器 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | ||
Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
A.该反应的正方应为吸热反应
B.达到平衡时,容器I中的CH3OH体积分数比容器Ⅱ中的小
C.容器I中反应达到平衡所需时间比容器Ⅲ中的长
D.若起始时向容器I中充入CH3OH 0.1mol、CH3OCH30.15mol和H2O 0.10mol,则反应将向正反应方向进行