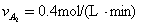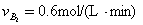题目内容
把一块锌放在100mL pH值为1的盐酸中,经2min后pH值变为2,则H2产生速度是
| A.0.5 mol/(L·min) |
| B.0.0225 mol/(L·min) |
| C.0.0045mol/(L·min) |
| D.0.00225mol/(L·min) |
B
溶液的pH值从1变为2,则[H+]从0.1mol/L变为0.01mol/L,即[H+]的变化值为(0.1-0.01)=0.09mol/L。
根据反应方程式:Zn+2H+=Zn2++H2↑
2 1
0.09mol/L 0.045mol/L,
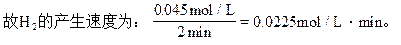
根据反应方程式:Zn+2H+=Zn2++H2↑
2 1
0.09mol/L 0.045mol/L,

练习册系列答案
 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目

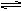 2HI,反应进行到2min时测得反应速率υ(HI)=0.1mol/(L·min),I2(g)的物质的量浓度为0.4mol/L。
2HI,反应进行到2min时测得反应速率υ(HI)=0.1mol/(L·min),I2(g)的物质的量浓度为0.4mol/L。 2CO(g)△H>0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab过程中改变的条件可能是 ;bc过程中改变的条件可能是 ;
2CO(g)△H>0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab过程中改变的条件可能是 ;bc过程中改变的条件可能是 ;
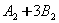

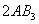 反应来说,以其反应速率的表示中,速率最快的是( )。
反应来说,以其反应速率的表示中,速率最快的是( )。