题目内容
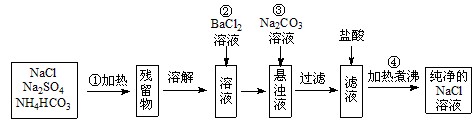
(8分) 实验室里需要纯净的氯化钠溶液,但手边只有混有硫酸钠、碳酸氢铵的氯化钠。某学生设计了如下方案:
如果此方案正确,那么:
(1)操作①中碳酸氢铵受热(100℃以上)可分解生成氨气、水和二氧化碳的混合气,该混合气的平均摩尔质量为 。(数值保留到小数点后一位)
(2)操作②为什么不能改为加硝酸钡溶液?__________________________________。
(3)操作③的目的是__________________________________(结合化学方程式回答)。
(4)操作④的目的是____________________________________________________。

如果此方案正确,那么:
(1)操作①中碳酸氢铵受热(100℃以上)可分解生成氨气、水和二氧化碳的混合气,该混合气的平均摩尔质量为 。(数值保留到小数点后一位)
(2)操作②为什么不能改为加硝酸钡溶液?__________________________________。
(3)操作③的目的是__________________________________(结合化学方程式回答)。
(4)操作④的目的是____________________________________________________。
(每空2分,共8分)(1)26.3g/mol
(2)改用Ba(NO3)2会使溶液中引入新的杂质离子NO3—,以后操作中无法除去
(3)发生反应BaCl2+Na2CO3=BaCO3↓+2NaCl用以除去过量的Ba2+
(4)除去溶解在溶液中的二氧化碳
(2)改用Ba(NO3)2会使溶液中引入新的杂质离子NO3—,以后操作中无法除去
(3)发生反应BaCl2+Na2CO3=BaCO3↓+2NaCl用以除去过量的Ba2+
(4)除去溶解在溶液中的二氧化碳
(1)碳酸氢铵分解的化学方程式是NH4HCO3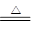 NH3↑+H2O+CO2↑,所以混合气的平均相对分子质量是
NH3↑+H2O+CO2↑,所以混合气的平均相对分子质量是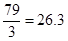 ,因此混合气的平均摩尔质量是26.3g/mol。
,因此混合气的平均摩尔质量是26.3g/mol。
(2)除杂是不能在引入新的杂质,而改用Ba(NO3)2会使溶液中引入新的杂质离子NO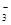 ,以后操作中无法除去,因此不能改为加硝酸钡溶液。
,以后操作中无法除去,因此不能改为加硝酸钡溶液。
(3)由于溶液中还有钡离子,所以加入碳酸钠的目的是除去过量的Ba2+。
(4)加入盐酸酸化时,会生成CO2气体。而溶液中有溶解的CO2,所以加热煮沸的目的是除去溶解在溶液中的CO2。
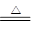 NH3↑+H2O+CO2↑,所以混合气的平均相对分子质量是
NH3↑+H2O+CO2↑,所以混合气的平均相对分子质量是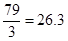 ,因此混合气的平均摩尔质量是26.3g/mol。
,因此混合气的平均摩尔质量是26.3g/mol。(2)除杂是不能在引入新的杂质,而改用Ba(NO3)2会使溶液中引入新的杂质离子NO
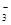 ,以后操作中无法除去,因此不能改为加硝酸钡溶液。
,以后操作中无法除去,因此不能改为加硝酸钡溶液。(3)由于溶液中还有钡离子,所以加入碳酸钠的目的是除去过量的Ba2+。
(4)加入盐酸酸化时,会生成CO2气体。而溶液中有溶解的CO2,所以加热煮沸的目的是除去溶解在溶液中的CO2。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目