题目内容
下列现象或事实可用同一原理解释的是
A氯化铵晶体和碘晶体加热都产生气体
B.明矾和液氯都可用于处理生活用水
C.漂白粉和过氧化钠都可用于漂白有色织
D.常温下,铁和铜分别放在浓硫酸中都无明显现象
C
解析

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目
下列实验的现象与对应结论均正确的是
| 选项 | 操作 | 现象 | 结论 |
| A | 将浓硫酸滴到蔗糖表面 | 固体变黑膨胀 | 浓硫酸有脱水性和强氧化性 |
| B | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al与浓硝酸不反应 |
| C | 将一小块Na放入无水乙醇中 | 产生气泡 | Na能置换出醇羟基中的氢 |
| D | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下发生反应 |
下列陈述中,Ⅰ、Ⅱ都正确且两者间具有因果关系的一组是
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | FeCl3溶液能腐蚀Cu | Fe的金属性强于Cu |
| B | Na2O2使酚酞溶液变红 | Na2O2是碱性氧化物 |
| C | Cl2可部分与水反应 | 用排饱和食盐水法收集Cl2 |
| D | 浓H2SO4可干燥NO和SO2 | NO和SO2还原性都弱 |
下列有关说法正确的是( )
| A.大多数金属在自然界以游离态形式存在 |
| B.工业上,一般用热还原法获得Hg和Ag |
| C.铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸 |
| D.人们常用钢作建造材料而不用纯铁主要原因是钢的机械性能更好 |
下列图示与对应的叙述相符的是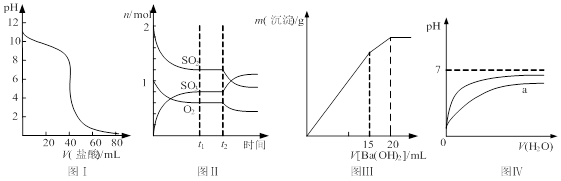
| A.图Ⅰ表示盐酸滴加到0.1 mol/L某碱溶液得到的滴定曲线,用已知浓度盐酸滴定未知浓度该碱时最好选取酚酞作指示剂 |
B.图Ⅱ表示一定条件下进行的反应2SO2+O2 2SO3 各成分的物质的量变化,t2时刻改变的条件可能是缩小容器体积 2SO3 各成分的物质的量变化,t2时刻改变的条件可能是缩小容器体积 |
| C.图Ⅲ表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20 mL Ba(OH)2溶液时铝离子恰好沉淀完全 |
| D.图Ⅳ表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线a对应的是盐酸 |
下列反应所得溶液中只含一种溶质的是
| A.A1Cl3溶液中滴入过量NaOH溶液 |
| B.Fe2(SO4)3溶液中加入过量铁粉 |
| C.稀HNO3中加入少量铜片 |
| D.Ca(ClO)2溶液中通入过量CO2 |
将一定量Fe和Fe2O3混合物放入2 mol·L-1的HNO3溶液25mL中,反应完成后,无固体剩余,生成224mLNO气体(标准状况),再向反应后的溶液中加入1 mol·L-1的NaOH溶液,要使铁元素全部沉淀下来,所加NaOH溶液的体积最少是
| A.45mL | B.50mL | C.40mL | D.无法确定 |
相同质量的铝分别与足量的稀盐酸和氢氧化钠溶液反应,下列说法不正确的是
| A.相同条件下,产生气体的体积相等 |
| B.生成的铝的化合物的物质的量相等 |
| C.消耗酸和碱的物质的量相等 |
| D.相同条件下,转移的电子数相等 |
等体积、等物质的量浓度的盐酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加等质量的铝,生成氢气的体积比为5:6(相同状况),则甲、乙两烧杯中的反应情况可能分别是
| A.甲、乙中都是铝过量 | B.甲中铝过量,乙中碱过量 |
| C.甲中酸过量,乙中铝过量 | D.甲中酸过量,乙中碱过量 |