��Ŀ����
��һ�������������Ժ�CO2������Ӧ��Fe(s)+CO2(g) FeO(s)+CO(g) ��H>0��
FeO(s)+CO(g) ��H>0��
(1)���д�ʩ����ʹƽ��ʱc(CO)/c(CO2)������� (�����)��
A.�����¶� B.����ѹǿ
C.����һ�������� D.�ټ���һЩ����
(2)��Ӧ�ﵽƽ��������������������ʱ����ͨ��һ������CO2��ʹCO2��Ũ�ȳ�Ϊԭ����2������CO2��ת���ʽ� (���������С�����䡱)��
����һ���¶��µ�ij�ݻ��ɱ���ܱ������У��������л�ѧƽ�⣺C(s)+H2O(g)  CO(g)+H2(g)���Է����ͻش��������⣺
CO(g)+H2(g)���Է����ͻش��������⣺
(1)���϶��������淴Ӧ��һ���������Ѵﵽ��ѧƽ��״̬���� (ѡ�����)��
A����ϵ��ѹǿ���ٷ����仯
B��v��(CO)=v��(H2O)
C������n mol CO��ͬʱ����n mol H2
D��1 mol H��H�����ѵ�ͬʱ����2 mol H��O��
(2)��������ѧƽ��״̬������Ӧ��ʼ�������ﵽƽ���ƽ����ϵ��ѹ(��С�ݻ���������������)���������������ƽ����Է��������� (��д�����䡱������С�����)��
��(1)A (2)���� ��(1)B��D (2)���
����

 �������ϵ�д�
�������ϵ�д�Һ����������������ش���������
��1��һ�����������ܱ������з�����Ӧ��
a��NH4I(s)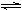 NH3(g) + HI(g) b��2HI(g)
NH3(g) + HI(g) b��2HI(g) 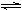 H2(g) + I2(g)
H2(g) + I2(g)
��д����Ӧa��ƽ�ⳣ������ʽ
�ڴﵽƽ������������������Ӧb���ƶ����� ��������������ƶ��������ﵽ�µ�ƽ��ʱ��������ɫ�������仯 ������������dz�����䡱��
��2����ҵ�Ϻϳɰ��ķ�Ӧ��N2(g)��3H2(g) 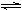 2NH3(g) ��H����92.60 kJ��mol��1
2NH3(g) ��H����92.60 kJ��mol��1
����˵����˵��������Ӧ������Ӧ������е���________(�����)��
a����λʱ��������2n mol NH3��ͬʱ����3n mol H2
b����λʱ��������6n mol N��H����ͬʱ����2n mol H��H��
c����N2��H2��NH3�����ʵ���Ũ�ȱ仯��ʾ�ķ�Ӧ����֮��Ϊ1��3��2
d����������ƽ��Ħ����������
e�������ڵ������ܶȲ���
��3����֪�ϳɰ���Ӧ��ij�¶���2 L���ܱ������н��У�����������ݣ�
| ʱ��(h) ���ʵ���(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | | 1.00 | 1.00 |
���ݱ������ݼ��㣺
�ٷ�Ӧ���е�2 hʱ�ų�������Ϊ________ kJ��
��0��1 h��N2��ƽ����Ӧ����Ϊ________ mol��L��1��h��1��
�۴��¶��¸÷�Ӧ�Ļ�ѧƽ�ⳣ��K��________(������λС��)��
�ܷ�Ӧ�ﵽƽ�������ƽ����ϵ���ټ���N2��H2��NH3��1.00 mol����ѧƽ�⽫��________�����ƶ�(�����Ӧ�����淴Ӧ��)��
��4���£�N2H4��������������NH3����������ˮ����ˮ��Ӧ����һ�ֶ�Ԫ��������Һ�зֲ����룬�������ӷ�Ӧ����ʽ��ʾ��ˮ��Һ�Լ��Ե�ԭ��
úֱ��ȼ�յ����������ʽϵͣ�Ϊ����������ʣ���ҵ�Ͻ�ú����(ת���CO��H2)���ٺϳ��Ҵ��������ѵȶ�����Դ��
(1)��ͼ��ʾ��һ������ȼ�ϵ�ؾƾ�����ǣ������Զ������� ���������ƵĹ��ܣ��dz��ʺϽ����ֳ��ƾ���⡣�õ�صĸ�����ӦʽΪ______________________��
(2)ú����������������ڹ�ҵ�ϳɶ����ѣ��䷴Ӧ���£�
2CO(g)��4H2(g) CH3OCH3(g)��H2O(g)��
CH3OCH3(g)��H2O(g)��
ͬʱ��������Ӧ��CO(g)��2H2(g) CH3OH(g)��CO(g)��H2O(g)??CO2(g)��H2(g)��
CH3OH(g)��CO(g)��H2O(g)??CO2(g)��H2(g)��
���¶�Ϊ250 �桢ѹǿΪ3.0 MPaʱ��ij������Ͷ�ϱ�V(H2)��V(CO) ��a����������ƽ��ʱ��Ӧ��ϵ�и���ֵ�����������±���
| ���� | H2 | CO | CO2 | (CH3)2O | CH3OH(g) | H2O(g) |
| ������� | 0.54 | 0.045 | 0.18 | 0.18 | 0.015 | 0.03 |
��Ͷ�ϱ�a��________��
��250��ʱ��ӦCO(g)��H2O(g)
 CO2(g)��H2(g)��ƽ�ⳣ��K��________��
CO2(g)��H2(g)��ƽ�ⳣ��K��________�� ��һ���������İ�������粒����������Ƶ��ܱ���������У���������������䣬��������������Բ��ƣ����ں㶨�¶���ʹ��ﵽ�ֽ�ƽ�⣺NH2COONH4��s��  2NH3��g����CO2��g��
2NH3��g����CO2��g��
ʵ���ò�ͬ�¶��µ�ƽ�����������±���
| �¶�/�� | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| ƽ����ѹ ǿ/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| ƽ��������Ũ��/mol�� L��1 | 2.4�� 10��3 | 3.4�� 10��3 | 4.8�� 10��3 | 6.8�� 10��3 | 9.4�� 10��3 |
��1�������жϸ÷ֽⷴӦ�Ѿ��ﵽƽ�����________��
A��2v��NH3����v��CO2��
B���ܱ���������ѹǿ����
C���ܱ������л��������ܶȲ���
D���ܱ������а����������������
��2�����ݱ������ݣ���ʽ����25.0 ��ʱ�ķֽⷴӦƽ�ⳣ����_______________��
��3��ȡһ�����İ�������粒������һ�����������ܱ���������У���25.0 ���´ﵽ�ֽ�ƽ�⡣���ں�����ѹ�������������������粒����������________������ӡ��������١����䡱����
һ���¶��£���2L�ܱ�������NO2��O2�ɷ������з�Ӧ�� 4NO2(g)+O2(g)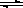 2N2O5(g)+5286 kJ��֪��ϵ��n(NO2)��ʱ��仯���±���
2N2O5(g)+5286 kJ��֪��ϵ��n(NO2)��ʱ��仯���±���
| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
��1����˵���÷�Ӧ�Ѵﵽƽ��״̬���� ��
A��v��NO2��=4v��O2�� B��������ѹǿ���ֲ���
C��v����N2O5��=2v����O2�� D���������ܶȱ��ֲ���
��2����Ӧ�ﵽƽ���NO2��ת����Ϊ ���� ʱ����ͨ��һ������������NO2��ת���ʽ� (���������С���������䡱)��
��3��ͼ���ܱ�ʾN2O5��Ũ�ȱ仯�������� ����O2��ʾ��0~500s�ڸ÷�Ӧ��ƽ������v= ��
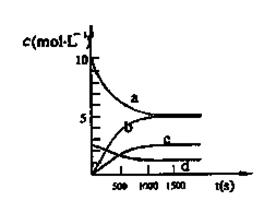
��4����ʹ�÷�Ӧ�ķ�Ӧ����������ƽ������Ӧ�����ƶ����� ��
A����ʱ�����NO2���� B���ʵ������¶�
C������O2��Ũ�� D��ѡ���Ч����
 xC��g����2D��g������5min���D��Ũ��Ϊ0.5mol/L��c��A����c��B����3��5��C��ƽ����Ӧ����Ϊ0.1mol/��L��min������
xC��g����2D��g������5min���D��Ũ��Ϊ0.5mol/L��c��A����c��B����3��5��C��ƽ����Ӧ����Ϊ0.1mol/��L��min������ 2CO(g)����H>0,���������CO2�����ʵ�����ʱ��t�ı仯��ϵ��ͼ��ʾ��
2CO(g)����H>0,���������CO2�����ʵ�����ʱ��t�ı仯��ϵ��ͼ��ʾ��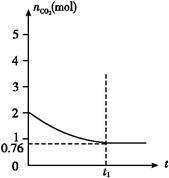
 4CO2(g)+N2(g) ��H="-1" 200 kJ��mol-1
4CO2(g)+N2(g) ��H="-1" 200 kJ��mol-1
 Fe(s)��CO2(g) ��H��0����֪��1 100 ��ʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ��K=0.263��
Fe(s)��CO2(g) ��H��0����֪��1 100 ��ʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ��K=0.263�� CH3OH(g)+H2O(g) ��H����49.0 kJ��mol-1���������Ϊ1 L���ܱ������У�����1 mol CO2��3 mol H2����Ӧ�����в��CO2��CH3OH(g)��Ũ����ʱ��ı仯��ͼ��ʾ��
CH3OH(g)+H2O(g) ��H����49.0 kJ��mol-1���������Ϊ1 L���ܱ������У�����1 mol CO2��3 mol H2����Ӧ�����в��CO2��CH3OH(g)��Ũ����ʱ��ı仯��ͼ��ʾ��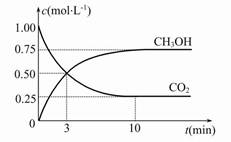
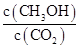 ������� (�����)��
������� (�����)��