题目内容
2.下列装置、试剂选用或操作正确的是( )| A. |  除去NO中的NO2 | B. | 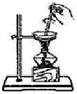 用于AlCl3蒸发结晶 | ||
| C. | 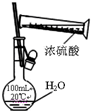 稀释浓硫酸 | D. | 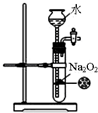 制备少量O2 |
分析 A.NO2与水反应生成NO;
B.蒸发时氯化铝水解生成的HCl挥发;
C.不能在容量瓶中稀释浓硫酸;
D.过氧化钠为粉末固体,不能利用止水夹使固体与液体分离制备少量气体.
解答 解:A.NO2与水反应生成NO,则导管长进短出、洗气可除杂,故A正确;
B.蒸发时氯化铝水解生成的HCl挥发,直接蒸发不能得到氯化铝,应在HCl气流中蒸发得到氯化铝,故B错误;
C.不能在容量瓶中稀释浓硫酸,应在烧杯中稀释、冷却后转移到容量瓶中,故C错误;
D.过氧化钠为粉末固体,不能利用止水夹使固体与液体分离制备少量气体,装置不合理,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及混合物分离提纯、盐类水解、溶液配制及气体制备实验等,把握物质的性质、反应原理、实验装置的作用为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
12.利用可再生能源代替石油和煤已经成为未来发展的趋势,甲醇作为重要的可再生能源具有广泛的开发和应用前景.工业上常利用反应CO(g)+2H2(g)?CH3OH(g)△H<0来合成甲醇.
(1)经研究发现在230℃~270℃时合成最为有利.为探寻合成气最合适的起始组成比,分别在230℃、250℃和270℃时进行实验,实验结果如图.230℃的实验结果所对应的曲线是X(填字母); 从提高CO转化率的角度等综合分析,该温度下工业生产适宜采用的合成气组成n(H2):n(CO)的比值范围是B(填字母).
A.1~1.5 B.2.5~3C.3.5~4.5
(2)制甲醇所需要的氢气,可通过下列反应制取:H2O(g)+CO(g)?H2(g)+CO2(g),△H<0,某温度下该反应的平衡常数K=1.回答下列问题:
①该温度下,若起始时c(CO)=2mol•L-1,c(H2O)=3mol•L-1,反应进行一段时间后,测得CO的浓度为1mol•L-1,则此时该反应v(正)>v(逆)(填“>”、“<”或“=”).
②若降低温度,该反应的K值将增大(填“增大”、“减小”或“不变”).
(3)甲醇是一种化工原料,工业上合成甲醇的反应:CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ•mol-1.
若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
①容器内压强P:P甲、P乙与P丙的关系是P甲=P乙<P丙(用“>”、“<”或“=”表示);
②变化的热量数值Q中,Q1 与Q2的和是90.8(填具体数值).
(4)目前,以甲醇为原料的燃料电池已经应用于工业生产.如图是甲醇燃料电池应用的示意图,已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O, ,
,
请根据上图填写下列空白:
乙池中A电极的电极反应式为Ag++e-=Ag,甲池中通入CH3OH电极的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O.
(1)经研究发现在230℃~270℃时合成最为有利.为探寻合成气最合适的起始组成比,分别在230℃、250℃和270℃时进行实验,实验结果如图.230℃的实验结果所对应的曲线是X(填字母); 从提高CO转化率的角度等综合分析,该温度下工业生产适宜采用的合成气组成n(H2):n(CO)的比值范围是B(填字母).
A.1~1.5 B.2.5~3C.3.5~4.5

(2)制甲醇所需要的氢气,可通过下列反应制取:H2O(g)+CO(g)?H2(g)+CO2(g),△H<0,某温度下该反应的平衡常数K=1.回答下列问题:
①该温度下,若起始时c(CO)=2mol•L-1,c(H2O)=3mol•L-1,反应进行一段时间后,测得CO的浓度为1mol•L-1,则此时该反应v(正)>v(逆)(填“>”、“<”或“=”).
②若降低温度,该反应的K值将增大(填“增大”、“减小”或“不变”).
(3)甲醇是一种化工原料,工业上合成甲醇的反应:CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ•mol-1.
若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molCO、2molH2 | 1mol CH3OH | 2molCO、4molH2 |
| CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 放出Q1 kJ | 吸收Q2 kJ | 放出Q3 kJ |
②变化的热量数值Q中,Q1 与Q2的和是90.8(填具体数值).
(4)目前,以甲醇为原料的燃料电池已经应用于工业生产.如图是甲醇燃料电池应用的示意图,已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O,
 ,
,请根据上图填写下列空白:
乙池中A电极的电极反应式为Ag++e-=Ag,甲池中通入CH3OH电极的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O.
10.下列各组离子以适当比例混合,可以形成无色透明碱性溶液的是( )
| A. | Na+、Ba2+、OH-、SO42- | B. | Ag+、NH4+、OH-、NO3- | ||
| C. | Mg2+、Na+、AlO2-、OH- | D. | MnO4-、Al3+、SO42-、Cl- |
17.下列叙述正确的是( )
| A. | 中和pH和体积均相同的盐酸和醋酸溶液,消耗相同浓度的NaOH的体积较多的是醋酸 | |
| B. | FeCl3溶液和Fe2(SO4)3溶液蒸干、灼烧都得到Fe2O3 | |
| C. | 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)减小 | |
| D. | 向0.1mol/L的氨水中加入少量硫酸铵固体,则溶液中c(OH-)/c(NH3•H2O)增大 |
14.下列各组物质,按化合物、单质、混合物的顺序排列的是( )
| A. | 生石灰、白磷、熟石灰 | B. | 干冰、铁、氯化氢 | ||
| C. | 天然气、氮气、胆矾 | D. | 烧碱、液态氧、碘酒 |
11.下列各电离方程式中,书写正确的是( )
| A. | H2CO3?2H++CO32- | B. | KHSO4?K++H++SO42- | ||
| C. | Ba(OH)2?Ba2++2OH- | D. | NaHCO3═Na++HCO3- |

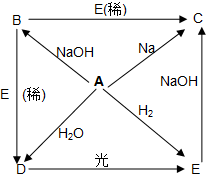 已知A、B、C、D、E五种物质都含有相同的元素X,这五种物质间相互转化关系如下:
已知A、B、C、D、E五种物质都含有相同的元素X,这五种物质间相互转化关系如下: