题目内容
18.氧化钠是常见的潜艇供氧剂,并且具有强氧化性.(1)请写出Na2O2作为潜艇供氧剂,其中所发生的一个化学方程式:2Na2O2+2CO2═2Na2CO3+O2,若生成1mol O2,电子转移数目为2NA;
(2)已知在一定条件下,过氧化钠集合可与所有常见的气态非金属氧化物反应,如2Na2O2+2CO2=2Na2CO3+O2和Na2O2+CO=Na2CO3+,试分别写出Na2O2与SO2,SO3反应的化学方程式:2Na2O2+2SO2═2Na2SO4、2Na2O2+2SO3═2Na2SO4+O2;
(3)有一化学兴趣小组将Na2O2投入水中,待完全反应后,滴入酚酞试液,溶液变红,接着又褪色.甲同学认为是有一部分过氧化钠还未反应完全,过氧化钠具有强氧化性,故将溶液漂白;乙同学认为Na2O2与水反应生成氢氧化钠和过氧化氢,过氧化氢具有漂白性,故将溶液氧化漂白.丙同学认为只要往Na2O2与水完全反应后生成的溶液中先加一种物质,一段时间后再滴加酚酞溶液,看溶液变红后是否褪色便可以证明甲乙同学谁的观点正确,你认为丙同学需要加入MnO2.
分析 (1)过氧化钠与二氧化碳反应生成碳酸钠和氧气,氧元素化合价-1价变化为0价和-2价;
(2)由题给信息可知,过氧化钠与低价态的非金属氧化物发生化合反应,生成该非金属的最高价态的含氧酸盐,此时没有氧气产生;
(3)过氧化氢在二氧化锰作用下会分解生成氧气和水,在加入酚酞变红色不褪色说明是过氧化氢的氧化性使变红色的溶液褪色,否则是过氧化钠的氧化性作用.
解答 解:(1)Na2O2在潜水艇中作为提供氧气的来源,反应原理为过氧化钠与二氧化碳反应生成碳酸钠和氧气,反应的化学方程式为:2Na2O2+2CO2═2Na2CO3+O2,
氧元素化合价-1价变化为0价和-2价,若生成1mol O2,电子转移数目为2NA,
故答案为:2Na2O2+2CO2═2Na2CO3+O2;2NA;
(2)根据根据过氧化钠和二氧化碳的反应,可以推知过氧化钠和二氧化硫反应生成亚硫酸钠和氧气,亚硫酸钠易被氧气氧化为硫酸钠,即SO2+Na2O2=Na2SO4,三氧化硫和过氧化钠反应生成硫酸钠和氧气,即2Na2O2+2SO3═2Na2SO4+O2,
故答案为:2Na2O2+2SO2═2Na2SO4、2Na2O2+2SO3═2Na2SO4+O2;
(3)Na2O2+2H2O=2NaOH+H2O2,往Na2O2与水完全反应后生成的溶液中加入少量二氧化锰,待不再产生气泡,再滴入酚酞试液,溶液只变红不褪色证明过氧化氢的氧化性使变红色的溶液褪色,说明乙同学正确,若变红色后褪色说明是过氧化钠的氧化性说明甲同学正确,
故答案为:MnO2.
点评 本题考查了钠及其化合物性质的分析应用,注意信息的分析判断,化学方程式的书写方法,掌握基础是解题关键,题目难度中等.

练习册系列答案
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
8.下列实验操作不能达到实验目的是( )
| 选项 | 实验目的 | 实验操作 |
| A | 证明乙烯有还原性 | 将乙烯气体通入酸性KMnO4溶液中 |
| B | 比较H2O和乙醇中羟基氢的活泼性 | 分别加入少量Na |
| C | 检验溴乙烷中的溴原子 | 加入NaOH溶液,加热,然后加入AgNO3溶液 |
| D | 鉴别1-丙醇和2-丙醇 | 核磁共振氢谱 |
| A. | A | B. | B | C. | C | D. | D |
10.下列装置所示的实验能达到实验目的是( )
| A. |  分离碘酒中的碘和酒精 | B. |  滴定法测定盐酸的浓度 | ||
| C. | 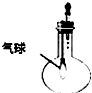 验证NH3的溶解性 | D. |  比较Na2CO2、NaHCO2的热稳定性 |
7.下列醇或卤代烃在合适条件下,也不能产生烯烃的是( )
| A. |  | B. | CH3Br | C. |  | D. |  |
8.关于维生素的下列说法正确的是( )
| A. | 维生素一般可分为脂溶性和水溶性 | |
| B. | 维生素容易在内积存,主要积存在肝脏 | |
| C. | 维生素容易被人体吸收,多余的随尿排出体外,不易在体内积存,所以容易缺乏 | |
| D. | 维生素C可以防治夜盲症 |
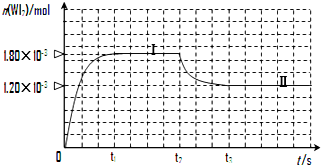 碘钨灯具有使用寿命长、节能环保等优点.一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应:W(s)+I2(g)?WI2(g)
碘钨灯具有使用寿命长、节能环保等优点.一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应:W(s)+I2(g)?WI2(g)