题目内容
1.实验表明:多元强酸的稀溶液第一步电离是完全的,第二步电离并不完全.请判断下列说法正确的是( )| A. | 浓度(mol/L)相同的稀硫酸和NaHSO4 溶液中,前者中的SO42-浓度大 | |
| B. | pH相同,体积相同的NaHSO4和H2SO4溶液和足量的锌反应,后者放出氢气的量多 | |
| C. | 浓度相同,体积相同的盐酸和硫酸和足量的锌反应,放出氢气量相同 | |
| D. | 体积相同,pH相同的盐酸和硫酸分别与铝片反应,反应过程中速率不同 |
分析 硫酸是二元强酸,第一步电离是完全的,第二步电离并不完全,
A、相同浓度的稀硫酸和NaHSO4 溶液中,硫酸第一步电离出来的氢离子会抑制第二步电离;
B、氢离子浓度相同的稀硫酸和NaHSO4 溶液中,NaHSO4 溶液中c(HSO4-)大;
C、盐酸是一元酸,硫酸是二元酸,相同浓度的盐酸和硫酸,硫酸溶液中氢离子物质的量大;
D、硫酸第二步电离可逆,pH相同的盐酸和硫酸中,硫酸中存在硫酸氢根离子.
解答 解:硫酸是二元强酸,第一步电离是完全的,第二步电离并不完全,存在电离平衡,
A、相同浓度的稀硫酸和NaHSO4 溶液中,硫酸第一步电离出来的氢离子会抑制第二步电离,所以NaHSO4 溶液中SO42-浓度大,故A错误;
B、氢离子浓度相同的稀硫酸和NaHSO4 溶液中,NaHSO4 溶液中c(HSO4-),pH相同,体积相同的NaHSO4和H2SO4溶液和足量的锌反应,前者放出氢气的量多,故B错误;
C、盐酸是一元酸,硫酸是二元酸,相同浓度的盐酸和硫酸和足量的锌反应,硫酸溶液中放出的氢气多,故C错误;
D、硫酸第二步电离可逆,pH相同的盐酸和硫酸中,硫酸中存在硫酸氢根离子,存在电离平衡,pH相同的盐酸和硫酸分别与铝片反应,反应过程中硫酸速率比盐酸快,故D正确;
故选D.
点评 本题考查了电离平衡的相关知识,注意第一步电离是完全的,第二步电离并不完全,存在电离平衡,题目难度不大.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
11.下列离子方程式正确的是( )
| A. | 硫酸钠溶液与氢氧化钡溶液反应:SO42-+Ba2+═BaSO4↓ | |
| B. | 大理石与稀硝酸反应:CO32-+2H+═CO2↑+H2O | |
| C. | 氯化铁溶液与碘化钾溶液反应:Fe3++2I-═Fe2++I2 | |
| D. | 氯化镁容液与氨水反应:Mg2++2OH-═Mg(OH)2↓ |
12.下列各项操作中不发生先沉淀后溶解现象的是( )
| A. | 向饱和Na2CO3溶液中通入过量CO2 | |
| B. | 向Fe(OH)3胶体中逐滴滴加入过量H2SO4溶液 | |
| C. | 向石灰水中通入过量CO2 | |
| D. | 向NaAlO2溶液中逐滴加入盐酸至过量 |
9.下列物质既能使酸性高锰酸钾溶液褪色,又能使溴水褪色的是( )
| A. | 乙酸乙酯 | B. | 甲烷 | C. | 乙酸 | D. | 植物油 |
6.化工行业的发展必须符合国家节能减排的总体要求.请回答下列问题:
(1)已知C(s)+H2O(g)?CO(g)+H2(g),则该反应的平衡常数表达式为$\frac{{C({H_2})C(CO)}}{{C({H_2}O)}}$.
(2)已知在一定温度下,
C(s)+CO2(g)?2CO(g)△H1
CO(g)+H2O(g)?H2(g)+CO2(g)△H2
C(s)+H2O(g)?CO(g)+H2(g)△H3
则△H1、△H2、△H3之间的关系是:△H1+△H2=△H3.
(3)通过研究不同温度下平衡常数可以解决某些实际问题.已知等体积的一氧化碳和水蒸气进入反应时,会发生如下反应:CO(g)+H2O(g)?H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示.
则该反应的正反应方向是放热反应(填“吸热”或“放热”),在500℃时,若设起始时CO和H2O的起始浓度均为0.020mol/L,则CO的平衡转化率为75%.
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等.对反应N2O4(g)?2NO2(g)△H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是D:
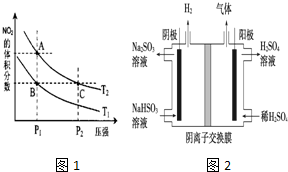
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态A到状态B,可以用加热的方法
E.A、C两点的化学平衡常数:A=C
(5)工业上用Na2SO3吸收尾气中的SO2,再用右图装置电解(惰性电极)NaHSO3制取H2SO4(阴离子交换膜只永许阴离子通过),阳极电极反应式为:4OH--4e-=2H2O+O2↑.
(1)已知C(s)+H2O(g)?CO(g)+H2(g),则该反应的平衡常数表达式为$\frac{{C({H_2})C(CO)}}{{C({H_2}O)}}$.
(2)已知在一定温度下,
C(s)+CO2(g)?2CO(g)△H1
CO(g)+H2O(g)?H2(g)+CO2(g)△H2
C(s)+H2O(g)?CO(g)+H2(g)△H3
则△H1、△H2、△H3之间的关系是:△H1+△H2=△H3.
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
则该反应的正反应方向是放热反应(填“吸热”或“放热”),在500℃时,若设起始时CO和H2O的起始浓度均为0.020mol/L,则CO的平衡转化率为75%.
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等.对反应N2O4(g)?2NO2(g)△H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是D:

A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态A到状态B,可以用加热的方法
E.A、C两点的化学平衡常数:A=C
(5)工业上用Na2SO3吸收尾气中的SO2,再用右图装置电解(惰性电极)NaHSO3制取H2SO4(阴离子交换膜只永许阴离子通过),阳极电极反应式为:4OH--4e-=2H2O+O2↑.
10.某无色溶液中加入过量的稀盐酸有沉淀生成,过滤后向碱溶液中加入过量的纯碱溶液又有沉淀生成,下列溶液中符合此条件的是( )
①Ag+、Fe3+、Na+
②Ag+、Al3+、K+
③Ag+、Ba2+、NO${\;}_{3}^{-}$
④SiO${\;}_{3}^{2-}$、AlO${\;}_{2}^{2-}$、K+
⑤Ag+、NH${\;}_{4}^{+}$、H+
⑥AlO2-、K+、Al3+.
①Ag+、Fe3+、Na+
②Ag+、Al3+、K+
③Ag+、Ba2+、NO${\;}_{3}^{-}$
④SiO${\;}_{3}^{2-}$、AlO${\;}_{2}^{2-}$、K+
⑤Ag+、NH${\;}_{4}^{+}$、H+
⑥AlO2-、K+、Al3+.
| A. | ①②⑤ | B. | ②③④ | C. | ②③④⑥ | D. | ①②③④⑥ |
11.pH=a的某电解质溶液中,插入两只惰性电极,通直流电一段时间后,停止电解,取出电极,将溶液摇匀,测得溶液的pH>a,则该电解质溶液是( )
| A. | K2SO4 | B. | NaOH | C. | NaCl | D. | AgNO3 |
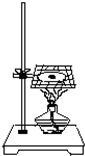 如图所示,将一小块钠放在石棉网上加热.回答下列问题:
如图所示,将一小块钠放在石棉网上加热.回答下列问题: