��Ŀ����
����Ŀ��ʵ������Ҫ0.1molL��1NaOH��Һ500mL��������Һ������������ش��������⣺
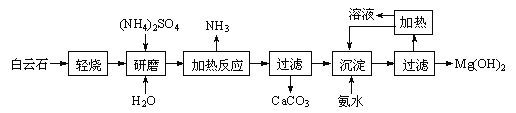
��1�����ƹ������貣�������У��ձ�����Ͳ����ͷ�ιܡ��� ��
��2��Ҫ��ɱ�ʵ��Ӧ����NaOH�����������
��3��������Һʱ��һ����Է�Ϊ���¼������裺�ټ��㣻�ڳ�������������ȴ����ת�ƣ������߶��ݣ��൹תҡ�ȣ�
��4����ͼװ����ijͬѧ���ƴ���Һʱת�Ʋ�����ʾ��ͼ��ͼ�еĴ����� 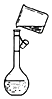
��5�������ƹ����У������������������ȷ�ģ����в���������Ũ��ƫ�͵��� ��
������ƿ�����������������ˮ
�ڶ���ʱ���ӿ̶���
��ת����Һʱ������������Һ��������ƿ����
�ܶ���ҡ�Ⱥ���Һ����ڿ̶��ߣ��ٲ�����������ˮ���̶���
��6��NaOH��Һ������ɺ�ȡ100mL����Һ��100mL������Һ��ϣ�ǡ����ȫ�кͣ����������Һ�����ʵ���Ũ��ΪmolL��1 ��
���𰸡�
��1����������500mL����ƿ
��2��2.0g
��3���ܽ⣻ϴ��
��4��δ�ò���������
��5���ۢ�
��6��0.1
���������⣺��1��������Һ�����ձ����ܽ⡢��ȴ��ת�Ƶ�����ƿ�ж��ݣ����貣�������У��ձ�����Ͳ����ͷ�ιܡ���������500mL����ƿ��
�ʴ�Ϊ����������500mL����ƿ����2������NaOH�����������m=nVM=0.1mol/L��0.5L��40g/mol=2.0g��
�ʴ�Ϊ��2.0g����3��������Һʱ��һ����Է�Ϊ���¼������裺�ټ��㣻�ڳ��������ܽ⣻����ȴ����ת�ƣ���ϴ�ӣ��߶��ݣ��൹תҡ�ȣ�
�ʴ�Ϊ���ܽ⣻ϴ�ӣ���4��ͼ�еĴ�����δ�ò������������ʴ�Ϊ��δ�ò�����������5��������ƿ�����������������ˮ����ʵ����Ӱ�죬�ʲ�ѡ��
�ڶ���ʱ���ӿ̶��ߣ�VƫС����cƫ�ߣ��ʲ�ѡ��
��ת����Һʱ������������Һ��������ƿ���棬nƫС��cƫ�ͣ���ѡ��
�ܶ���ҡ�Ⱥ���Һ����ڿ̶��ߣ��ٲ�����������ˮ���̶��ߣ�Vƫ��cƫ�ͣ���ѡ��
�ʴ�Ϊ���ۢܣ���6��ǡ����ȫ�кͣ���0.1L��0.1mol/L=0.1L��c�����ᣩ��c=0.1mol/L���ʴ�Ϊ��0.1��
��1��������Һ�����ձ����ܽ⡢��ȴ��ת�Ƶ�����ƿ�ж��ݣ���2�����m=nVM���㣻��3��������Һʱ��һ����Է�Ϊ���¼������裺�ټ��㣻�ڳ��������ܽ⣻����ȴ����ת�ƣ���ϴ�ӣ��߶��ݣ��൹תҡ�ȣ���4��ת��Һ����Ҫ��������������5����c= ![]() ��֪��nƫС��Vƫ�������Ũ��ƫ�ͣ���6��ǡ����ȫ�кͣ���0.1L��0.1mol/L=0.1L��c�����ᣩ���Դ������
��֪��nƫС��Vƫ�������Ũ��ƫ�ͣ���6��ǡ����ȫ�кͣ���0.1L��0.1mol/L=0.1L��c�����ᣩ���Դ������

 �¿α�����Ķ�ѵ��ϵ�д�
�¿α�����Ķ�ѵ��ϵ�д� ������������Ӧ����ϵ�д�
������������Ӧ����ϵ�д�