题目内容
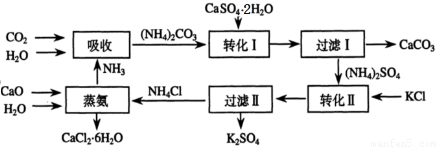
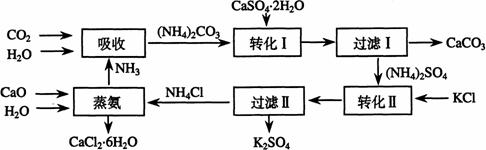
将磷肥生产中形成的副产物石膏(CaSO4·2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图。
(1)本工艺中所用的原料除CaSO4·2H2O、CaCO3、H2O外,还需要 等原料。
(2)写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式: 。
(3)过滤Ⅰ操作所得滤液是(NH4)2SO4溶液。检验滤液中含有CO32-的操作方法是:
_________________________________________________________________。
(4)若过滤I的滤液中的Ca2+浓度低于1.0×10-5 mol·L-1时可认为被沉淀完全。若要使Ca2+沉淀完全,则滤液中CO32-离子的物质的量浓度不得低于 。
(已知:Ksp(CaCO3)=5.0×10-9)
(5)写出蒸氨过程中的化学方程式 。
(6)氯化钙结晶水合物(CaCl2·6H2O)是目前常用的无机储热材料,选择的依据是 。
a.熔点较低(29℃熔化) b.能导电 c.能制冷 d.无毒
(13分)
(1)KCl NH3 (2分,少写1个或错写1个扣1分)
(2)CaSO4+CO32-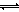 CaCO3+SO42-(2分,离子符号错,得0分,用等号也给分)
CaCO3+SO42-(2分,离子符号错,得0分,用等号也给分)
(3)用滴管取少量滤液于试管中,滴加盐酸,若产生气泡,证明滤液中含有CO32-(3分,每项1分,少一项扣1分)
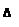 (4)5.0×10-4mol/L(2分,没有写单位扣1分)
(4)5.0×10-4mol/L(2分,没有写单位扣1分)
(5)CaO+2NH4Cl+5H2O=CaCl2·6H2O+2NH3↑(2分,未配平或无“↑”或“Δ”共扣1分)
(6)a d(2分,少1个或错1个扣1分)
【解析】(1)观察工艺流程图可知,左侧需要加入的CO2、CaO是右侧产生的CaCO3热分解的产物,而右侧加入的KCl和NH3也是需要消耗的原料;(2)石膏悬浊液中存在如下溶解平衡:CaSO4(s)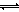 Ca2++SO42-,加入的(NH4)2CO3是可溶性碳酸盐,该溶液中的CO32-与Ca2+易发生生成更难溶的碳酸钙沉淀,即Ca2++CO32-=CaCO3↓,减小生成物浓度使上述平衡右移,实现了沉淀的转化,则总反应为CaSO4+CO32-
Ca2++SO42-,加入的(NH4)2CO3是可溶性碳酸盐,该溶液中的CO32-与Ca2+易发生生成更难溶的碳酸钙沉淀,即Ca2++CO32-=CaCO3↓,减小生成物浓度使上述平衡右移,实现了沉淀的转化,则总反应为CaSO4+CO32-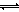 CaCO3+SO42-;(3)CO32-不仅能与Ca2+反应生成白色沉淀,而且与稀盐酸或稀硫酸容易反应放出无色无味的气体,这是CO32-的特征反应,因此取少量滤液,加入适量盐酸,若产生气泡,说明滤液中存在碳酸根离子;(4)CaCO3(s)
CaCO3+SO42-;(3)CO32-不仅能与Ca2+反应生成白色沉淀,而且与稀盐酸或稀硫酸容易反应放出无色无味的气体,这是CO32-的特征反应,因此取少量滤液,加入适量盐酸,若产生气泡,说明滤液中存在碳酸根离子;(4)CaCO3(s)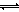 Ca2++CO32-,Ksp(CaCO3)= c(Ca2+)•c(CO32-)=5.0×10-9,若c(Ca2+)=1.0×10-5
mol·L-1,则c(CO32-)= 5.0×10-4mol·L-1,为了使溶液中c(Ca2+)<1.0×10-5
mol·L-1,则c(CO32-)≥5.0×10-4mol·L-1;(5)观察工艺流程图中蒸氨步骤可知,反应物为CaO、H2O、NH4Cl,生成物为CaCl2•6H2O、NH3,反应条件为加热,没有元素化合价变化,不涉及氧化还原反应,设CaCl2•6H2O的系数为1,根据钙原子、氯原子、氢原子守恒可得:CaO+2NH4Cl+5H2O=CaCl2·6H2O+2NH3↑;(6)a项,熔点较低,温度大于29℃时容易吸收热量熔化,温度小于29℃时容易凝固,故a正确;b项,酸、碱、盐等化合物在水溶液里或熔融状态下都能导电,金属、合金、石墨等都能导电,CaCl2•6H2O固体时不能导电,故b错误;c项,虽然CaCl2•6H2O固体能吸收热量,但是一定量CaCl2•6H2O固体能吸收热量的能力并非很强,因而不能制冷,仅仅能储热,故c错误;d项,CaCl2•6H2O不是重金属盐,无毒,使用安全,故d正确。
Ca2++CO32-,Ksp(CaCO3)= c(Ca2+)•c(CO32-)=5.0×10-9,若c(Ca2+)=1.0×10-5
mol·L-1,则c(CO32-)= 5.0×10-4mol·L-1,为了使溶液中c(Ca2+)<1.0×10-5
mol·L-1,则c(CO32-)≥5.0×10-4mol·L-1;(5)观察工艺流程图中蒸氨步骤可知,反应物为CaO、H2O、NH4Cl,生成物为CaCl2•6H2O、NH3,反应条件为加热,没有元素化合价变化,不涉及氧化还原反应,设CaCl2•6H2O的系数为1,根据钙原子、氯原子、氢原子守恒可得:CaO+2NH4Cl+5H2O=CaCl2·6H2O+2NH3↑;(6)a项,熔点较低,温度大于29℃时容易吸收热量熔化,温度小于29℃时容易凝固,故a正确;b项,酸、碱、盐等化合物在水溶液里或熔融状态下都能导电,金属、合金、石墨等都能导电,CaCl2•6H2O固体时不能导电,故b错误;c项,虽然CaCl2•6H2O固体能吸收热量,但是一定量CaCl2•6H2O固体能吸收热量的能力并非很强,因而不能制冷,仅仅能储热,故c错误;d项,CaCl2•6H2O不是重金属盐,无毒,使用安全,故d正确。
考点:是物质制备工艺流程题,是近年高考的热点题型,涉及所用原料的判断、离子方程式和化学方程式的书写、常见阴离子的检验方法、溶度积公式的计算或应用、解释原因或依据等问题。

 暑假接力赛新疆青少年出版社系列答案
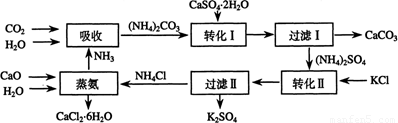
暑假接力赛新疆青少年出版社系列答案(07年上海卷)将磷肥生产中形成的副产物石膏(CaSO4?2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图。

(1)本工艺中所用的原料除CaSO4?2H2O、KCl外,还需要 等原料。
(2)写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式: 。
(3)过滤Ⅰ操作所得固体中,除CaCO3外还含有 (填化学式)等物质,该固体可用作生产水泥的原料。
(4)过滤Ⅰ操作所得滤液是(NH4)2SO4溶液。检验滤液中含有CO32-的方法是:________。
(5)已知不同温度下K2SO4在100g水中达到饱和时溶解的量如下表:
温度(℃) | 0 | 20 | 60 |
K2SO4溶解的量(g) | 7.4 | 11.1 | 18.2 |
60℃时K2SO4的饱和溶液591g冷却到0℃,可析出K2SO4晶体 g
(6)氯化钙结晶水合物(CaCl2?6H2O)是目前常用的无机储热材料,选择的依据是:
a 熔点较低(29℃熔化) b 能导电 c 能制冷 d 无毒
(7)上述工艺流程中体现绿色化学理念的是: 。
(1)本工艺中所用的原料除CaSO4·2H2O、KCl外,还需要 等原料
(2)写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式:
(3)过滤Ⅰ操作所得固体中,除CaCO3外还含有 (填化学式)等物质,该固体可用作生产水泥的原料。
(4)过滤Ⅰ操作所得滤液是(NH4)2SO4溶液。检验滤液中含有![]() 的方法是:
的方法是:
。
(5)已知不同温度下K2SO4在100g水中达到饱和时溶解的量如下表:
温度(℃) | 0 | 20 | 60 |
K2SO4溶解的量(g) | 7.4 | 11.1 | 18.2 |
60℃时K2SO4的饱和溶液591g冷却到0℃,可析出K2SO4晶体 g
(6)氯化钙结晶水合物(CaCl2·6H2O)是目前常用的无机储热材料,选择的依据是
a 熔点较低(29℃熔化) b 能导电 c 能制冷 d 无毒
(7)上述工艺流程中体现绿色化学理念的是: 。
将磷肥生产中形成的副产物石膏(CaSO4·2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图。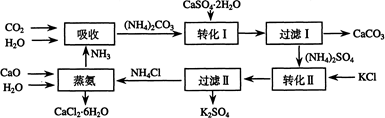
(1)本工艺中所用的原料除CaSO4·2H2O、KCl外,还需要 等原料
(2)写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式:
(3)过滤Ⅰ操作所得固体中,除CaCO3外还含有 (填化学式)等物质,该固体可用作生产水泥的原料。
(4)过滤Ⅰ操作所得滤液是(NH4)2SO4溶液。检验滤液中含有CO32-的方法是
(5)已知不同温度下K2SO4在100g水中达到饱和时溶解的量如下表:
| 温度(℃) | 0 | 20 | 60 |
| K2SO4溶解的量(g) | 7.4 | 11.1 | 18.2 |
(6)氯化钙结晶水合物(CaCl2·6H2O)是目前常用的无机储热材料,选择的依据是
a 熔点较低(29℃熔化) b 能导电 c 能制冷 d 无毒
(7)上述工艺流程中体现绿色化学理念的是: 。