��Ŀ����
����Ŀ������A��B��C��D���ֶ���������Ԫ�أ�����ԭ����������������֪B��Dͬ���塣AԪ�ص�������ۺ�����۵ľ���ֵ֮��Ϊ2��1molC����������ˮ��Ӧ���ڱ�״��������11.2LH2��D���ĵ��Ӳ�ṹ��Arԭ����ͬ����ش��������⣺
������ͼ��ʽ���ڱ���Ӧλ�ñ��A��B��C��D����Ԫ�ص�Ԫ�ط��š�ͬʱ��ͼ�н�����Ԫ��Ϳ�ڡ�
 _____________
_____________
���õ���ʽ��ʾB��C�γɻ�����Ĺ���___________��
��ͼ�С��ء���D�γɵļ����ӵİ뾶��СΪ________________�������ӷ��ź͡�>������=����<����ʾ����
��Ԫ�طǽ�����ǿ���Ƚ��кܶ��������A��D�ķǽ�����ǿ�����о������бȽϿ��е���_______������ţ���
�ٱȽ����ֵ��ʵ���ɫ�ڱȽ��⻯����ȶ���
�۱Ƚ�ԭ�Ӱ뾶��С�ܱȽ�����������Ӧˮ���������
��AԪ��������������Ԫ���е�һ��Ԫ���γɹ��ۻ���������е�ԭ�Ӹ�����Ϊ1:3����Է�������Ϊ120.5��������ʵĽṹʽΪ____________��
���𰸡� 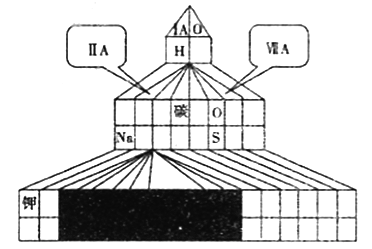
![]() r(Cl-)>r(K+) �ڢ�
r(Cl-)>r(K+) �ڢ� 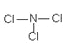
��������A��B��C��D���ֶ���������Ԫ�أ�����ԭ��������������D���ĵ��Ӳ�ṹ��Arԭ����ͬ����DΪClԪ�أ�B��Dͬ���壬��BΪFԪ�أ�1molC����������ˮ��Ӧ���ڱ�״��������11.2LH2�����������ʵ���Ϊ11.2L��22.4L/mol=0.5mol����C�ļ۵�����Ϊ0.5mol��2/1mol=1�����ڵڢ�A�壬ԭ����������FԪ�أ���CΪNaԪ�أ�AԪ�ص�������ۺ�����۵ľ���ֵ֮��Ϊ2��A����������Ϊ5��ԭ������С��Fԭ�ӣ���AΪNԪ�ء�
��1����ʽԪ�����ڱ���ʵ���ǽ�ԭ���ڱ��Ŀ�϶���ֽ�����ɾ���γɵģ���ԭԪ�����ڱ�û�б��ʵ������ڵ�������֮��Ģ�A�͢�A֮��Ϊ����Ԫ�أ���Ԫ�������ڱ���������ͼ�� ����2���õ���ʽ��ʾF��Na�γ�NaF���γɹ���Ϊ��
����2���õ���ʽ��ʾF��Na�γ�NaF���γɹ���Ϊ��![]() ����3��K+��Cl-�ĵ��Ӳ�ṹ��ͬ���˵����Խ�����Ӱ뾶ԽС�������ӵİ뾶r��Cl-����r�� K+������4���ٵ��ʵ���ɫΪ�������ʣ�����˵���ǽ�����ǿ�������ڷǽ�����Խǿ���⻯��Խ�ȶ��ԣ����⻯���ȶ��Կ���˵������Ԫ�صķǽ�����ǿ������ȷ����ԭ�Ӱ뾶��С��ԭ�ӽṹ��Ӱ��Ԫ�طǽ����Ի����������أ���ԭ�Ӱ뾶��С����˵���ǽ���ǿ������������������Ӧˮ���������Խǿ������Ԫ�طǽ�����Խǿ����ȷ����Ϊ���ڢ�����5��NԪ��������������Ԫ���е�һ��Ԫ���γɹ��ۻ���������е�ԭ�Ӹ�����Ϊ1��3����ΪNR3�ͣ���Է�������Ϊ120.5��R�����ԭ������Ϊ(120.517)/3=35.5��ΪClԪ�أ��û�����ΪNCl3��������Nԭ����Clԭ��֮���γ�1�Թ��õ��Ӷԣ�������ʵĽṹʽΪ
����3��K+��Cl-�ĵ��Ӳ�ṹ��ͬ���˵����Խ�����Ӱ뾶ԽС�������ӵİ뾶r��Cl-����r�� K+������4���ٵ��ʵ���ɫΪ�������ʣ�����˵���ǽ�����ǿ�������ڷǽ�����Խǿ���⻯��Խ�ȶ��ԣ����⻯���ȶ��Կ���˵������Ԫ�صķǽ�����ǿ������ȷ����ԭ�Ӱ뾶��С��ԭ�ӽṹ��Ӱ��Ԫ�طǽ����Ի����������أ���ԭ�Ӱ뾶��С����˵���ǽ���ǿ������������������Ӧˮ���������Խǿ������Ԫ�طǽ�����Խǿ����ȷ����Ϊ���ڢ�����5��NԪ��������������Ԫ���е�һ��Ԫ���γɹ��ۻ���������е�ԭ�Ӹ�����Ϊ1��3����ΪNR3�ͣ���Է�������Ϊ120.5��R�����ԭ������Ϊ(120.517)/3=35.5��ΪClԪ�أ��û�����ΪNCl3��������Nԭ����Clԭ��֮���γ�1�Թ��õ��Ӷԣ�������ʵĽṹʽΪ![]() ��
��

 ����ͬ�����Ծ�ϵ�д�
����ͬ�����Ծ�ϵ�д�



