题目内容
下列表示对应化学反应或过程的离子方程式正确的是
| A.铜片插入硝酸银溶液中:Cu+Ag+=Cu2++Ag |
| B.碳酸氢钙与过量的NaOH溶液反应Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- |
C.用石墨作电极电解AlCl3溶液:2Cl-+2H2O Cl2↑+H2↑+2OH- Cl2↑+H2↑+2OH- |
| D.亚硫酸氢钠溶液显酸性:NaHSO3=Na++H++ SO32- |
B
解析试题分析:A、电荷不守恒,错误;B、碳酸钙量少,完全反应,Ca2+和HCO3-符合化学式中量的关系,正确;C、产生的碱与铝离子反应生成偏铝酸根离子,错误;D、亚硫酸氢钠溶液显酸性是因为亚硫酸氢根离子电离所致,HSO3- H++ SO32-,错误。
H++ SO32-,错误。
考点:考查离子方程式正误判断有关问题。

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
下列化学用语中表述正确的是( )
A.甲醛的电子式: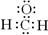 |
| B.二氧化硅的分子式SiO2 |
C.丙烷的分子球棍模型示意图: |
D.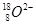 离子结构示意图: 离子结构示意图: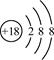 |
a mol FeS与b mol FeO投入到V L、c mol·L 的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看做是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为 ( )
的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看做是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为 ( )
①(a+b)×63 g②(a+b)×189 g ③(a+b) mol④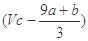 mol
mol
| A.①④ | B.②③ | C.①③ | D.②④ |
300 mL Al2(SO4)3溶液中,含Al3+为1.62 g,在该溶液中加入0.1 mol·L-1 Ba(OH)2溶液300 mL,反应后溶液中SO42-的物质的量浓度为( )
| A.0.4 mol·L-1 | B.0.3 mol·L-1 |
| C.0.2 mol·L-1 | D.0.1 mol·L-1 |
设NA为阿伏加德罗常数的值。下列说法正确的是( )
| A.0.44 g C3H8中含有的共价键总数目为0.1NA |
| B.标准状况下,2.24 L三氯甲烷中含有碳氯共价键的数目为0.3NA |
| C.25 ℃时,1 L pH=12的Na2CO3溶液中含有Na+的数目为0.02NA |
| D.1 mol冰醋酸和1 mol乙醇在加热和浓硫酸条件下充分反应生成的水分子数为NA |
36.5 g HCl溶解在1 L水中(水的密度近似为1 g/mL),所得溶液的密度为ρ g/mL,质量分数为w,物质的量浓度为c mol/L,NA表示阿伏加德罗常数的值,则下列叙述中正确的是( )
| A.所得溶液的物质的量浓度为1 mol/L |
| B.所得溶液中含有NA个HCl分子 |
| C.36.5 g HCl气体占有的体积为22.4 L |
| D.所得溶液的质量分数:w="36.5c/(1" 000ρ) |
设NA表示阿伏加德罗常数的值。下列说法正确的是( )
| A.标准状况下,0.1 mol Cl2溶于水,转移的电子数目为0.1NA |
| B.常温常压下,18 g H2O中含有的原子总数为3NA |
| C.标准状况下,11.2 L CH3CH2OH中含有的分子数目为0.5NA |
| D.常温常压下,2.24 L CO和CO2混合气体中含有的碳原子数目为0.1NA |
下列关于物质的量的叙述中,正确的是( )。
| A.1 mol任何物质都含有6.02×1023个分子 |
| B.0.012 kg12C中含有约6.02×1023个碳分子 |
| C.1 mol水中含有2 mol氢和1 mol氧 |
| D.1 mol Ne中含有6.02×1024个电子 |