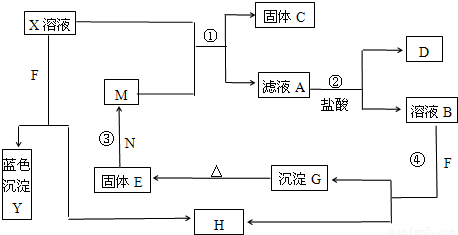
题目内容
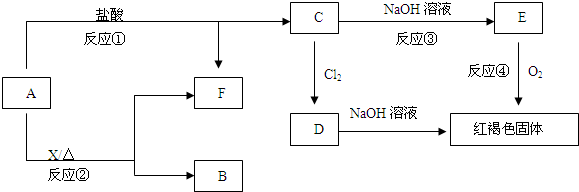
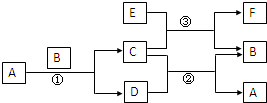
已知反应①为置换反应,B是磁性氧化物,它们之间能发生如下反应(部分产物未标出)
请根据以上信息回答下列问题:
(1)写出物质B、D的化学式:B: 、D: .
(2)分类思想是学习化学的重要方法,①②③④四个反应中有三个反应可归纳为一类反应,则这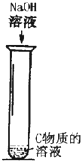 类反应的名称是 .写出下列反应的化学方程式:
类反应的名称是 .写出下列反应的化学方程式:
反应②
反应④ .
(3)如图所示,在C溶液中滴加NaOH溶液,观察到的实验现象是 ;写出反应③的离子反应方程式 .
(4)要验证某溶液是否含有微量的D物质的阳离子,通常选用一种盐的溶液,这种物质是 ,请简单表述实验方法 .

请根据以上信息回答下列问题:
(1)写出物质B、D的化学式:B:
(2)分类思想是学习化学的重要方法,①②③④四个反应中有三个反应可归纳为一类反应,则这
 类反应的名称是
类反应的名称是反应②
反应④
(3)如图所示,在C溶液中滴加NaOH溶液,观察到的实验现象是
(4)要验证某溶液是否含有微量的D物质的阳离子,通常选用一种盐的溶液,这种物质是
分析:①为置换反应,则说明A为单质,B是磁性氧化物,应为Fe3O4,则A为Fe,与盐酸反应生成C为金属氯化物,C与氢氧化钠反应生成E,E被氧气氧化生成红褐色固体,该红褐色固体为Fe(OH)3,则E为Fe(OH)2,C为FeCl2,C与氯气反应生成D为FeCl3,FeCl3能与NaOH溶液反应生成Fe(OH)3.根据转化关系可知,F为氢气,Fe与X再加热的条件下也可以生成氢气,应是Fe与水蒸气的反应生成四氧化三铁和氢气,则X为H2O,结合对应物质的性质以及题目要求解答该题.
解答:解:①为置换反应,则说明A为单质,B是磁性氧化物,应为Fe3O4,则A为Fe,与盐酸反应生成C为金属氯化物,C与氢氧化钠反应生成E,E被氧气氧化生成红褐色固体,该红褐色固体为Fe(OH)3,则E为Fe(OH)2,C为FeCl2,C与氯气反应生成D为FeCl3,FeCl3能与NaOH溶液反应生成Fe(OH)3.根据转化关系可知,F为氢气,Fe与X再加热的条件下也可以生成氢气,应是Fe与水蒸气的反应生成四氧化三铁和氢气,则X为H2O,
(1)由以上分析可知B为Fe3O4,D为FeCl3,故答案为:Fe3O4;FeCl3;
(2)①②④中都有单质参加反应,则一定发生氧化还原反应,反应②为铁和水蒸气的反应,方程式为3Fe+4H2O(g)
Fe3O4+4 H2,反应④为氢氧化亚铁与氧气的反应,方程式为4Fe(OH)2+O2+2H2O═4Fe(OH)3↓,
故答案为:氧化还原反应;3Fe+4H2O(g)
Fe3O4+4 H2;4Fe(OH)2+O2+2H2O═4Fe(OH)3↓;
(3)氯化亚铁与氢氧化钠反应生成氢氧化亚铁,生成的氢氧化亚铁不稳定,易被空气中氧气氧化为氢氧化铁,反应的方程式为Fe2++2 OH-=Fe(OH)2↓、4Fe(OH)2+O2+2H2O═4Fe(OH)3↓,现象为立即生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色,
故答案为:立即生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色;Fe2++2 OH-=Fe(OH)2↓;
(4)D为FeCl3,可用KSCN检验,可生成血红色物质,检验方法是取少量待检溶液与一支干净的试管中,滴加KSCN溶液,若溶液变红色,则原溶液含有Fe3+,无明显现象,则不含Fe3+,
故答案为:KSCN或硫氰化钾;取少量待检溶液与一支干净的试管中,滴加KSCN溶液,若溶液变红色,则原溶液含有Fe3+,无明显现象,则不含Fe3+.
(1)由以上分析可知B为Fe3O4,D为FeCl3,故答案为:Fe3O4;FeCl3;
(2)①②④中都有单质参加反应,则一定发生氧化还原反应,反应②为铁和水蒸气的反应,方程式为3Fe+4H2O(g)
| ||
故答案为:氧化还原反应;3Fe+4H2O(g)
| ||
(3)氯化亚铁与氢氧化钠反应生成氢氧化亚铁,生成的氢氧化亚铁不稳定,易被空气中氧气氧化为氢氧化铁,反应的方程式为Fe2++2 OH-=Fe(OH)2↓、4Fe(OH)2+O2+2H2O═4Fe(OH)3↓,现象为立即生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色,
故答案为:立即生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色;Fe2++2 OH-=Fe(OH)2↓;
(4)D为FeCl3,可用KSCN检验,可生成血红色物质,检验方法是取少量待检溶液与一支干净的试管中,滴加KSCN溶液,若溶液变红色,则原溶液含有Fe3+,无明显现象,则不含Fe3+,
故答案为:KSCN或硫氰化钾;取少量待检溶液与一支干净的试管中,滴加KSCN溶液,若溶液变红色,则原溶液含有Fe3+,无明显现象,则不含Fe3+.
点评:本题考查无机物的推断,为高考常见题型,侧重于学生的分析能力的考查,涉及Fe元素单质及其化合物的性质,生成红褐色固体为突破口,再根据转化关系进行推断,掌握Fe单质及化合物性质是关键,反应②推断为易错点、难点,题目没有过多的信息,需要学生熟练掌握Fe与水的反应.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案
相关题目
(10分)有①、②、③、④、⑤、⑥、⑦、⑧、⑨、⑩十种元素,原子序数依次增大,⑨、⑩处于第四周期,其余均为短周期元素。
(1) 若②、⑦、⑧三种元素在周期表中相对位置如下:
② |
|
|
|
|
| ⑦ | ⑧ |
②与⑦、②与⑧形成的液体化合物是常见的重要溶剂,则②、⑦、⑧三种元素最高价氧化物对应的水化物酸性由强到弱的顺序是: (用化学式表示)。
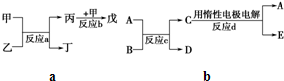
(2)若甲、乙、丙、丁、戊均为上述八种短周期元素中的某些元索组成的单质或由其中两种元素组成的化合物,且甲、戊为无色气体,反应a为置换反应,反应b为化合反应。见右图示转化关系推测:戊可能为: (列举合适的一例)。
 |
![]()
![]()
![]()
![]()
若甲是O2、乙是N2H4,反应a是在强碱性溶液中进行的的原电池反应,则负极发生的电极反应式为:
。
![]() (3)若右下图中A、B、C、D、E分别是上述10种元素中的某些元素组成的单质或其中两种元素组成的化合物.已知:A是常见的金属单质,反应c为置换反应类型。若反应c是用A作电极,在B的水溶液中进行电解反应,它们有如右图示转化关系。则反应d中阴极的电极反应式为:
(3)若右下图中A、B、C、D、E分别是上述10种元素中的某些元素组成的单质或其中两种元素组成的化合物.已知:A是常见的金属单质,反应c为置换反应类型。若反应c是用A作电极,在B的水溶液中进行电解反应,它们有如右图示转化关系。则反应d中阴极的电极反应式为:![]() 。
。
![]() 若反应c是在高温下进行的,且为工业上有重要应用价值的放热反应,当物质C是一种两性化合物,则反应c的化学方程式: 。
若反应c是在高温下进行的,且为工业上有重要应用价值的放热反应,当物质C是一种两性化合物,则反应c的化学方程式: 。
 |
![]()
![]()
![]()
 右图中所涉及的A、B、C、D、E、F和G都是中学化学教材中常见的物质.E为铝;B、D为单质,其余为化合物;反应①②③均在高温下进行且均为置换反应;A在常温下为液态,C有磁性,E、F既能溶于NaOH又能溶于HCl.
右图中所涉及的A、B、C、D、E、F和G都是中学化学教材中常见的物质.E为铝;B、D为单质,其余为化合物;反应①②③均在高温下进行且均为置换反应;A在常温下为液态,C有磁性,E、F既能溶于NaOH又能溶于HCl.