题目内容
硅及其化合物广泛应用于太阳能的利用、光导纤维及硅橡胶的制备等。
纯净的硅是从自然界中的石英矿石(主要成分为SiO2)中提取的。高温下制取纯硅有如下反应(方法1):
①SiO2(s)+2C(s) Si(s)+2CO(g)
Si(s)+2CO(g)
②Si(s)+2Cl2(g) SiCl4(g)
SiCl4(g)
③SiCl4(g)+2H2(g) →Si(s)+4HCl(g)
完成下列填空:
(1)硅原子核外有 种不同能级的电子,最外层的p电子有 种自旋方向。
(2)硅与碳同主族,单质的还原性:碳 硅(填写“同于”、“强于”或“弱于”)。反应①之所以能进行的原因是 。
(3)反应②生成的化合物的电子式为 ;该分子为 分子(填写“极性”或“非极性”)。
(4)某温度下,反应②在容积为V升的密闭容器中进行,达到平衡时Cl2的浓度为a mol/L。然后迅速缩小容器容积到0.5V升,t秒后重新达到平衡,Cl2的浓度为b mol/L。则:a b(填写“大于”、“等于”或“小于”)。
(5)在t秒内,反应②中v(SiCl4)= (用含a、b的代数式表示)。
(6)工业上还可以通过如下反应制取纯硅(方法2):
④Si(粗) +3HCl(g) 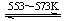 SiHCl3(l)+H2(g) + Q(Q>0)
SiHCl3(l)+H2(g) + Q(Q>0)
⑤SiHCl3(g)+H2(g) Si(纯)+3HCl(g)
Si(纯)+3HCl(g)
提高反应⑤中Si(纯)的产率,可采取的措施有: (选填2条)。
(1)5(1分) ,1(1分)
(2)弱于(1分) 因为生成物CO为气态,降低CO的浓度,可使平衡正向移动。(1分)
(3) (2分) 非极性(1分)
(2分) 非极性(1分)
(4)小于(1分)
(5)(2a-b)/2t mol/(L·s) (2分,代数式1分,单位1分)
(6)降低压强;升高温度;及时分离出HCl等(2分)(每条1分,合理给分,共2分。)
【解析】
试题分析:(1)硅原子核外电子排布式为1S22S22P63S23P2,共有5种不同能级的电子,最外层的p电子有自旋方向要相同所以只有1种自旋方向。
(2)硅与碳同主族,单质的还原性与元素的非金属性变化一致,故碳强于硅。反应①之所以能进行的原因是因为生成物CO为气态,降低CO的浓度,可使平衡正向移动。
(3)反应②生成的化合物是四氯化硅其电子式要保证每个原子达到8电子结构;该分子为是正四面体结构正负电核重心重全,故为非极性分子。
(4)反应②
Si(s)+2Cl2(g) SiCl4(g) 在容积为V升的密闭容器中进行,达到平衡时Cl2的浓度为a mol/L。然后迅速缩小容器容积到0.5V升,相当于加压,若平衡不移动,此时Cl2的浓度为2a mol/L,实际平衡右移了,t秒后重新达到平衡,Cl2的浓度必小于2a mol/L,但肯定大于a mol/L,b mol/L。故则:a 小于b。
SiCl4(g) 在容积为V升的密闭容器中进行,达到平衡时Cl2的浓度为a mol/L。然后迅速缩小容器容积到0.5V升,相当于加压,若平衡不移动,此时Cl2的浓度为2a mol/L,实际平衡右移了,t秒后重新达到平衡,Cl2的浓度必小于2a mol/L,但肯定大于a mol/L,b mol/L。故则:a 小于b。
(5)根据速率的定义可求得在t秒内,反应②中v(SiCl4) =(2a-b)/2t mol/(L·s) 。
(6)⑤ SiHCl3(g)+H2(g) Si(纯)+3HCl(g)要提高反应⑤中Si(纯)的产率,需要满足尽可能使平衡右移,可采取的措施有:降低压强;升高温度;及时分离出HCl等。
Si(纯)+3HCl(g)要提高反应⑤中Si(纯)的产率,需要满足尽可能使平衡右移,可采取的措施有:降低压强;升高温度;及时分离出HCl等。
考点:本题考查了原子结构,核外电子的排布,化学反应速率的计算及化学平衡的移动相关知识。

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案| A、硅酸钠可用于制备木材防火剂 | B、硅单质广泛用于光纤通讯 | C、利用盐酸刻蚀石英制作艺术品 | D、水晶项链是硅酸盐制品 |
| A、硅单质可用来制造太阳能电池 | B、装碱性溶液的玻璃试剂瓶不能用玻璃塞 | C、二氧化硅是制造光导纤维的材料 | D、二氧化硅属于酸性氧化物,不能与任何酸反应 |