题目内容
标准状况下,将4.48L的NO2和NO组成的混合气体通入以100mL的水中,气体体积缩小为2.24L,假设溶液的体积不变,则下列说法中不正确的是( )
分析:盛有NO和NO2的混合气体的试管倒立于水中发生3NO2+H2O=2HNO3+NO,利用方程式计算.
解答:解:A.根据3NO2+H2O=2HNO3+NO知,体积减少的物质的量和硝酸的物质的量相等,所以硝酸的物质的量=
×1=0.1mol,则硝酸的物质的量浓度=
=1mol/L,故A正确;
B.根据3NO2+H2O=2HNO3+NO知,二氧化氮既作氧化剂又作还原剂,气体体积减少的物质的量与转移电子的物质的量相等,则转移电子的物质的量=
=0.1mol,故B正确;
C.根据3NO2+H2O=2HNO3+NO知,气体体积减少的体积与二氧化氮的体积之比为2:3,所以二氧化氮的体积=
(4.48L-2.24L)=3.36L,则一氧化氮的体积为1.12L,所以原混合气体中NO2和NO的体积比为3:1,故C错误;
D.剩余气体都是一氧化氮,根据NO知,氮元素和氧元素的质量比等于其相对原子质量之比=14:16=7:8,故D正确;
故选C.
| 4.48L-2.24L |
| 22.4L/mol |
| 0.1mol |
| 0.1L |
B.根据3NO2+H2O=2HNO3+NO知,二氧化氮既作氧化剂又作还原剂,气体体积减少的物质的量与转移电子的物质的量相等,则转移电子的物质的量=
| 4.48L-2.24L |
| 22.4L/mol |
C.根据3NO2+H2O=2HNO3+NO知,气体体积减少的体积与二氧化氮的体积之比为2:3,所以二氧化氮的体积=
| 3 |
| 2 |
D.剩余气体都是一氧化氮,根据NO知,氮元素和氧元素的质量比等于其相对原子质量之比=14:16=7:8,故D正确;
故选C.
点评:本题考查了混合气体的有关计算,明确二氧化氮和水反应中二氧化氮和气体体积减少的关系是解本题关键,难度中等.

练习册系列答案
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案
相关题目
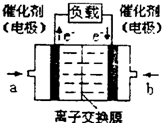
 (2012?信阳二模)如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.
(2012?信阳二模)如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.