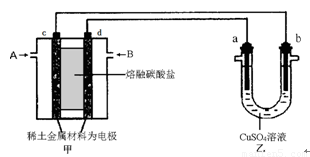
题目内容
能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料.
(1)在25℃、101kPa时,16g CH4完全燃烧生成液态水时放出的热量是890.31kJ,则CH4燃烧的热化学方程式是
(2)已知:C(s)+O2(g) CO2(g)△H=-437.3kJ?mol-1
H2(g)+
O2(g) H2O(g)△H=-285.8kJ?mol-1
CO(g)+
O2(g) CO2(g)△H=-283.0kJ?mol-1
则煤的气化主要反应的热化学方程式是:C(s)+H2O(g)═CO(g)+H2(g)
△H=
(1)在25℃、101kPa时,16g CH4完全燃烧生成液态水时放出的热量是890.31kJ,则CH4燃烧的热化学方程式是
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.31KJ/mol
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.31KJ/mol
.(2)已知:C(s)+O2(g) CO2(g)△H=-437.3kJ?mol-1
H2(g)+
| 1 |
| 2 |
CO(g)+
| 1 |
| 2 |
则煤的气化主要反应的热化学方程式是:C(s)+H2O(g)═CO(g)+H2(g)
△H=
131.5
131.5
kJ?mol-1.如果该反应△S=+133.7J?K-1?mol-1该反应在常温下能否自发进行?不能
不能
(填“能”或“不能”).分析:(1)根据热化学方程式的书写方法可知,化学计量数与反应热成正比,并注意标明物质的聚集状态来解答;
(2)根据热化学方程式和盖斯定律计算得到,反应焓变与反应过程无关;反应能自发,应满足△G=△H-T?△S<0,结合反应的△H和△S进行计算判断.
(2)根据热化学方程式和盖斯定律计算得到,反应焓变与反应过程无关;反应能自发,应满足△G=△H-T?△S<0,结合反应的△H和△S进行计算判断.
解答:解:(1)16g即1molCH4在氧气中燃烧生成CO2和液态水,放出889kJ热量,则热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.31KJ/mol,
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.31KJ/mol;
(2)①C(s)+O2(g)═CO2(g)△H1=-437.3kJ?mol-1
②H2(g)+
O2(g)═H2O(g)△H3=-285.8kJ?mol-1
③CO(g)+
O2(g)═CO2(g)△H=-283.0kJ?mol-1
依据盖斯定律①-②-③,得到:C(s)+H2O(g)═CO(g)+H2(g) n△H=+131.5kJ?mol-1,
△G=△H-T?△S=131.5kJ?mol-1-0.1337KJ?K-1?mol-1×298K=91.65kJ?mol-1>0,所以不能自发进行,
故答案为:131.5;不能;
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.31KJ/mol;
(2)①C(s)+O2(g)═CO2(g)△H1=-437.3kJ?mol-1
②H2(g)+
| 1 |
| 2 |
③CO(g)+
| 1 |
| 2 |
依据盖斯定律①-②-③,得到:C(s)+H2O(g)═CO(g)+H2(g) n△H=+131.5kJ?mol-1,
△G=△H-T?△S=131.5kJ?mol-1-0.1337KJ?K-1?mol-1×298K=91.65kJ?mol-1>0,所以不能自发进行,
故答案为:131.5;不能;
点评:本题考查热化学方程式书写、盖斯定律的计算应用以及反应自发性的判断,注意根据△G=△H-T?△S判断反应能否自发进行.

练习册系列答案
相关题目
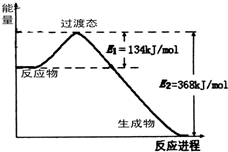 能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料.
能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料.  Fe(s)+CO2(g) ΔH>0,已知在1100℃时,该反应的化学平衡常数K=0.263。
Fe(s)+CO2(g) ΔH>0,已知在1100℃时,该反应的化学平衡常数K=0.263。