题目内容
将一定质量的Zn放入18mol/L的浓H2SO4中,充分反应后,共收集到标况下的气体4.48L,且1mol该气体的质量为48.5克。在反应后的溶液中,加入足量的BaCl2溶液,生成58.25克的沉淀。则求:
(1)所得气体的成份和各自的体积。
(2)所用Zn的质量。
(3)消耗浓H2SO4的体积为多少毫升(保留小数点一位)。
(1)所得气体的成份和各自的体积。
(2)所用Zn的质量。
(3)消耗浓H2SO4的体积为多少毫升(保留小数点一位)。
(1) V(SO2)="=3.36L " V(H2)==1.12L
(2) m(Zn)==13g
(3) V(H2SO4)==22.2mL
(2) m(Zn)==13g
(3) V(H2SO4)==22.2mL
略

练习册系列答案
相关题目
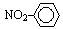


 组成元素相同,含有的电子数也相同
组成元素相同,含有的电子数也相同
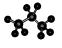
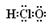
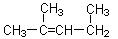 名称为1,3-二甲基―2―丁 烯
名称为1,3-二甲基―2―丁 烯