题目内容
用0.2mol/L HCl溶液滴定0.2mol/L NaOH,如果到达滴定的终点时不慎多加了1滴盐酸溶液(1滴溶液的体积约为0.05mL),继续加水至100mL,所得溶液的pH是
| A.4 | B.1 | C.10 | D.3.3 |
A
盐酸过量显酸性,溶液中氢离子浓度是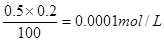 ,所以pH=4,答案选A。
,所以pH=4,答案选A。
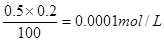 ,所以pH=4,答案选A。
,所以pH=4,答案选A。
练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目
题目内容
| A.4 | B.1 | C.10 | D.3.3 |
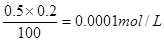 ,所以pH=4,答案选A。
,所以pH=4,答案选A。
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案