题目内容
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.常温下,0.1 mol·L-1的碳酸钠溶液中含有的阴离子数大于0.1NA
B.氢原子数为0.4NA的甲醇分子中含有的共价键数为0.4NA
C.6.4gS6与S8的混合物中所含S原子数一定为0.2NA
D.标准状况下,2.24LCl2与过量NaOH溶液反应转移电子数为0.2NA
【答案】C
【解析】
A.0.1 mol·L-1的碳酸钠溶液中碳酸根离子水解可使溶液中的阴离子数目增大,但未给出溶液体积,无法计算物质的量,则阴离子数无法计算,故A错误;
B.甲醇的结构简式为CH3OH,一个甲醇分子中含有5个共价键,氢原子数为0.4NA的甲醇分子的物质的量为0.1mol,含有的共价键数为0.1×5×NA=0.5NA,故B错误;
C.S6和S8的混合物中只有S原子,则硫原子的物质的量为![]() =0.2mol,则所含硫原子数一定为0.2NA,故C正确;
=0.2mol,则所含硫原子数一定为0.2NA,故C正确;
D.标况下,2.24L氯气的物质的量为0.1mol,与氢氧化钠溶液发生歧化反应,Cl2+2NaOH=NaCl+ NaClO+H2O,转移的电子的物质的量为0.1mol,转移的电子总数为0.1NA,故D错误;
答案选C。

【题目】Ⅰ.下表是元素周期表的一部分, 回答下列问题:
a | ||||||||
b | c | d | e | |||||
f | g | h | i |
(1)d、e、f对应简单离子的半径由大到小的顺序为_______(用具体微粒符号表示)。
(2)元素i的单质溶于水,生成一种具有漂白作用的化合物,该化合物的电子式为_____;写出a与c形成的一种含18电子且既含极性键又含非极性键的化合物的分子式_________。
(3)以元素a的单质为燃料,以f的最高价氧化物对应的水化物为电解质溶液,请写出该燃料电池的负极反应方程式_________。
Ⅱ. (1)根据下列信息判断氢气燃烧生成水时的热量变化:
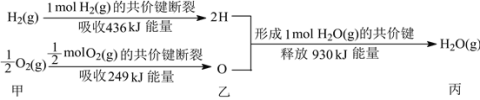
①H2(g)与O2(g)反应生成1molH2O(g)时放出的热量为________kJ;
②图中甲、乙、丙中物质所具有的总能量由大到小顺序为:________;
(2)铅蓄电池是最常见的二次电池,放电时的化学方程式为:Pb(s) + PbO2(s) + 2H2SO4(aq) = 2PbSO4(s) + 2H2O。负极反应式为__________,一段时间后,负极增重48克,转移电子_______mol。