题目内容
下列变化规律中,不正确的是
A.金属Mg、Na、K的熔沸点由高到低
B.C1-、Br-、I-的失电子能力由弱到强
C.H+、Li+、H-的半径由小到大
D.物质SiO2、SiC、Si中共价键由弱到强
D
解析试题分析:A、金属键越强金属晶体的熔沸点越高,金属离子半径越小,电荷数越多,金属键越强,因此金属Mg、Na、K的熔沸点由高到低,A正确;B、非金属性越强,相应阴离子的还原性越弱,所以C1-、Br-、I-的失电子能力由弱到强,B正确;C、核外电子层数越多微粒半径越大,核外电子排布相同的条件下原子序数越大,微粒半径越小,所以H+、Li+、H-的半径由小到大,C正确;D、非金属性越强形成的共价键越强,因此物质SiO2、SiC、Si中共价键由强到弱,D不正确,答案选D。
考点:考查元素周期律的应用

练习册系列答案
相关题目
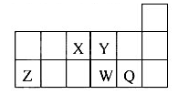
下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是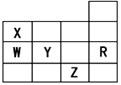
| A.常压下五种元素的单质中Z单质的沸点最高 |
| B.Y、Z的阴离子电子层结构都与R原子的相同 |
| C.W的氢化物的沸点比X的氢化物的沸点高 |
| D.Y元素的非金属性比W元素的非金属性强 |
已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是原子半径最小的元素,Y的最高正价与最低负价的代数和为0,Z的二价阳离子与氖原子具有相同的核外电子排布,W原子最外层电子数是最内层电子数的3倍。下列说法正确的是
| A.R的原子半径比Z的大 |
| B.R的氢化物的热稳定性比W的强 |
| C.X与Y形成的化合物只有一种 |
| D.Y的最高价氧化物的水化物的酸性比W的 |
元素R的最高价含氧酸分子式为HnRO2n -2 ,则在气态氢化物中,R元素的化合价为
| A.3n-12 | B.3n-6 | C.3n-4 | D.2n-4 |
对充有氖气的霓虹灯管通电,灯管发出红色光。产生这一现象的主要原因( )
| A.在电流的作用下,氖原子与构成灯管的物质发生反应 |
| B.电子由基态向激发态跃迁时吸收除红光以外的光线 |
| C.氖原子获得电子后转变成发出红光的物质 |
| D.电子由激发态向基态跃迁时以光的形式释放能量 |
氯元素在自然界有35Cl和37Cl两种同位素,在计算式:34.969×75.77%+36.966×24.23% =35.453中
| A.75.77%表示35Cl的质量分数 |
| B.24.23%表示35Cl的丰度 |
| C.35. 453表示氯元素的相对原子质量 |
| D.36.966表示37Cl的质量数 |
.我国稀土资源丰富。下列有关稀土元素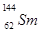 与
与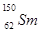 的说法正确的是
的说法正确的是
A.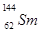 与 与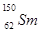 互为同位素 互为同位素 |
B.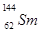 与 与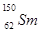 的质量数相同 的质量数相同 |
C.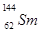 与 与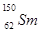 是同一种核素 是同一种核素 |
D.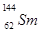 与 与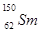 的核外电子数和中子数均为62 的核外电子数和中子数均为62 |
X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示。已知Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是( )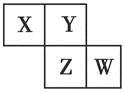
| A.原子半径:W>Z>Y>X |
| B.最高价氧化物对应水化物的酸性:Z>W>X |
| C.氢化物的稳定性:X>Y>Z |
| D.四种元素的单质中,Z单质的熔、沸点最高 |