题目内容
现有铁粉与Fe2O3组成的混合物m g投入到足量的稀H2SO4中,在标准状况下收集到V L H2,所得溶液遇KSCN溶液不显红色,则混合物中Fe2O3的质量为
A.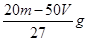 | B.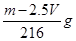 | C.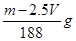 | D.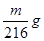 |
A
试题分析:由题意知有关反应为:①Fe2O3+ 3H2SO4= Fe2(SO4)3+ 3H2O ②Fe + Fe2(SO4)3= 3FeSO4;③Fe + H2SO4 = FeSO4 + H2 ↑, 所得溶液遇KSCN溶液不显红色,则溶液中没有Fe3+,所得溶液为FeSO4溶液。 在标准状况下收集到VL H2,其物质的量是V/22.4mol,由反应③知与稀硫酸反应的铁为V/22.4mol质量为2.5Vg。由反应①、②知其余的铁与Fe2O3的物质的量之比是1:1。设Fe2O3、Fe的物质的量为x 160x+56x=m—2.5V解得x=(m—2.5V)/216(mol),Fe2O3的质量为
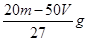

练习册系列答案
相关题目
 ×100%
×100%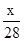 mol—1
mol—1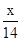 mol—1
mol—1