��Ŀ����
����Ŀ�����
��1������ԭ�ӣ� ![]() C��
C�� ![]() N��
N�� ![]() Na��
Na�� ![]() H��
H�� ![]() U��
U�� ![]() K��
K�� ![]() U�й�����Ԫ�أ��ֺ��أ���Ϊͬλ�أ�
U�й�����Ԫ�أ��ֺ��أ���Ϊͬλ�أ�
��2�������ӵ�������ΪN��AXn������x�����ӣ���N= ��
��3��������������NH3��Na2O��CO2��CaCl2��CCl4��H2O2��N2��NaHCO3��NaOH��Na2O2��NH4Cl���ں��Ǽ��Լ������ӻ��������
��4���������߷ֱ��ʾԪ�ص�ij��������˵�����Ĺ�ϵ��XΪ�˵������YΪԪ�ص��й����ʣ�����������Ԫ���йص�������������߱��������Ӧ�Ŀո��У� 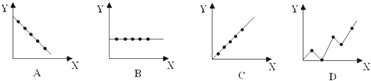
�ٵڢ�A��Ԫ�ص�������������
�ڵ�������Ԫ�ص�����ϼ���
�ۼ�������ʵ��۵� ��
���𰸡�
��1��6��7��![]() U��
U�� ![]() U
U
��2��A��x+n
��3��Na2O2
��4��B��C��A
���������⣺��1��ԭ�ӣ� ![]() C��
C�� ![]() N��
N�� ![]() Na��
Na�� ![]() H��
H�� ![]() U��
U�� ![]() K��
K�� ![]() U��
U�� ![]() U��
U�� ![]() U��������92������ͬһԪ�أ����Թ���6��Ԫ�أ�����һ����Ŀ���Ӻ�һ����Ŀ���ӵ�һ��ԭ�ӽ������أ����Թ���7�ֺ��أ�ԭ��AZX����������N��=��������Z������������A����
U��������92������ͬһԪ�أ����Թ���6��Ԫ�أ�����һ����Ŀ���Ӻ�һ����Ŀ���ӵ�һ��ԭ�ӽ������أ����Թ���7�ֺ��أ�ԭ��AZX����������N��=��������Z������������A���� ![]() U��
U�� ![]() U��������92����������ͬ������ͬλ�أ����Դ��ǣ�6��7��
U��������92����������ͬ������ͬλ�أ����Դ��ǣ�6��7�� ![]() U��
U�� ![]() U����2���������������У��˵����=������=������������������������AXn���˵����=������=x��n���ָ���������=������+����������AXn��������=��������������=A����x��n�������Դ��ǣ�A��x+n����3��NH3ֻ�����Լ������ڹ��ۻ����Na2Oֻ�����Ӽ����������ӻ����CO2ֻ�����Լ������ڹ��ۻ���� CaCl2ֻ�����Ӽ����������ӻ����CCl4ֻ�����Լ������ڹ��ۻ����H2O2�����Լ����Ǽ��Լ������ڹ��ۻ����N2ֻ���Ǽ��Լ������ڹ��ۻ���� NaHCO3�к������Ӽ��ͼ��Լ����������Ӽ������NaOH�к������Ӽ��ͼ��Լ����������Ӽ������NH4Cl�к������Ӽ��ͼ��Լ����������Ӽ������ Na2O2�к������Ӽ��ͷǼ��Լ����������Ӽ���������Դ��ǣ�Na2O2����4���٢�A��Ԫ�ص�������������ȣ�ͼ��B���ϣ����Դ��ǣ�B���ڵ�3���ڵ�����ϼ۴�������������ߣ�ͼ��C���ϣ����Դ��ǣ�C�������������ڽ������壬�뾶Խ������Խ�����۷е�Խ�ͣ����������ʵ��۵���ԭ����������������ͣ�ͼ��A���ϣ����Դ��ǣ�A��
U����2���������������У��˵����=������=������������������������AXn���˵����=������=x��n���ָ���������=������+����������AXn��������=��������������=A����x��n�������Դ��ǣ�A��x+n����3��NH3ֻ�����Լ������ڹ��ۻ����Na2Oֻ�����Ӽ����������ӻ����CO2ֻ�����Լ������ڹ��ۻ���� CaCl2ֻ�����Ӽ����������ӻ����CCl4ֻ�����Լ������ڹ��ۻ����H2O2�����Լ����Ǽ��Լ������ڹ��ۻ����N2ֻ���Ǽ��Լ������ڹ��ۻ���� NaHCO3�к������Ӽ��ͼ��Լ����������Ӽ������NaOH�к������Ӽ��ͼ��Լ����������Ӽ������NH4Cl�к������Ӽ��ͼ��Լ����������Ӽ������ Na2O2�к������Ӽ��ͷǼ��Լ����������Ӽ���������Դ��ǣ�Na2O2����4���٢�A��Ԫ�ص�������������ȣ�ͼ��B���ϣ����Դ��ǣ�B���ڵ�3���ڵ�����ϼ۴�������������ߣ�ͼ��C���ϣ����Դ��ǣ�C�������������ڽ������壬�뾶Խ������Խ�����۷е�Խ�ͣ����������ʵ��۵���ԭ����������������ͣ�ͼ��A���ϣ����Դ��ǣ�A��
�����㾫����������Ŀ����֪���������ú��ص����֪ʶ���Եõ�����Ĵ𰸣���Ҫ���պ��ط��ţ���2713Al��3216S��168O���Ͻ�Ϊ�����������½�Ϊ��������

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ���±��г��ˢ١������Ԫ�������ڱ��е�λ�ã�
��A | �� | ||||||
�� | ��A | ��A | ��A | ��A | ��A | ��A | |
�� | �� | �� | �� | ||||
�� | �� | �� | �� | ||||
�밴Ҫ��ش��������⣮
��1����ѧ��������õ�Ԫ�ص�ԭ�ӽṹʾ��ͼΪ
��2���ޢܢߵ��⻯����ȶ�����ǿ���ǣ���д�⻯��Ļ�ѧʽ����
��3��Ԫ�آۢܢ��γɵ����Ӱ뾶�ɴ�С��˳�����������ӷ��ű�ʾ��
��4���õ���ʽ��ʾԪ�آ���ߵĻ�������γɹ��̣� ��
����Ŀ��������Xͨ��BaCl2��Һ��������������ͨ��Y���壬�г������ɡ���X��Y�������ǣ� ��
ѡ�� | X | Y |
A | SO2 | H2S |
B | SO2 | Cl2 |
C | NH3 | CO2 |
D | Cl2 | CO2 |
A.AB.BC.CD.D