题目内容
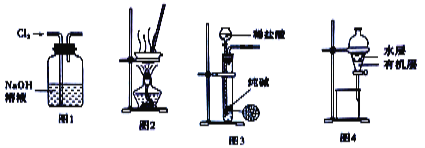
【题目】I:中学实验进行电解饱和食盐水时可从下图中选用必要的装置,并要求测定产生氢气的体积(大于25 mL),和检验氯气的氧化性。
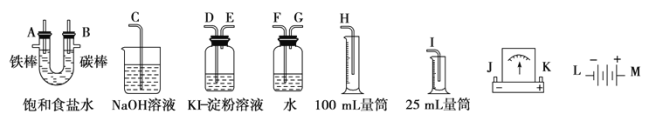 (1)写出电解饱和食盐水的离子方程式______________。
(1)写出电解饱和食盐水的离子方程式______________。
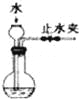
(2)电源、电流表与A、“两极的正确连接顺序为:L→( )→( )→( )→( )→M。
(3)该实验测定产生氢气的体积时,选用的量筒为__________(填25 mL量筒或50 mL量筒)
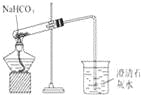
II:工业中的氯碱工业是离子交换膜法电解精制饱和食盐水如下图,离子交换膜只允许阳离子通过。
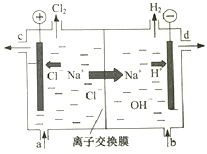
完成下列填空:
(4)粗食盐的水溶液含有SO42-、Ca2+、Mg2+。若要除去SO42-,则需加的试列为___________。
(5)精制饱和食盐水从图中_位置补充,氢氧化钠溶液从图中________位置流出(选填“a”、“”“b”、“c”或“d”)
(6)0.1mol/L的Na2SO3溶液中各离子浓度从人到小的顺序为___________。
(7)室温下,0.1mol/L的NaClO溶液的pH________0.1mol/L的Na2SO3溶液的pH.(选填“大于”、“小于”或“等于”)(已知:H2SO3 K1=1.54×10-2 K2=1.02×10-7 ;HClO K=2.95×10-8)
【答案】(1)2Cl-+2H2O![]() Cl2↑+H2↑+2OH-;
Cl2↑+H2↑+2OH-;
(2)A B J K(或J K A B);(3)50mL量筒;
(4)BaCl2或Ba(OH)2;(5)a:d;
(6)c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+);(7)大于
【解析】
试题分析:(1)电解饱和食盐水时,溶液中的阳离子H+在阴极得到电子变为H2逸出,使附近的水溶液显碱性,溶液中的阴离子Cl-在阳极失去电子,发生氧化反应产生Cl2,反应的离子方程式是2Cl-+2H2O![]() Cl2↑+H2↑+2OH-。
Cl2↑+H2↑+2OH-。
(2)若电解饱和NaCl溶液来测定产生的H2的体积并检验Cl2的氧化性。则应该使A与电源的负极连接,作阴极,B作阳极,与电源的正极相连,则与A、B两极的正确连接顺序为L→J→K→A→B→M。
(3)由于产生的H2的体积大于25 mL,所以应该选择50ml的量筒。
(4)由于不能引入新杂志,所以除去粗食盐的水溶液的SO42-,需加的试列为BaCl2或Ba(OH)2;
(5)随着电解的进行,溶质NaCl不断消耗,所以应该及时补充。精制饱和食盐水从与阳极连接的图中a位置补充,由于阴极H+不断放电,附近的溶液显碱性,氢氧化钠溶液从图中d位置流出;水不断消耗,所以从b口不断加入蒸馏水,从c位置流出的是稀的NaCl溶液。
(6)亚硫酸钠水解溶液显碱性,则0.1mol/L的Na2SO3溶液中各离子浓度从大到小的顺序为c(Na+) > c(SO32-) > c(OH-) > c(HSO3-) > c(H+);
(7)NaClO、Na2SO3都是强碱弱酸盐,弱酸根离子发生水解反应,消耗水电离产生的H+,破坏了水的电离平衡,当最终达到平衡时,溶液中c(OH-)>c(H+),所以溶液显碱性。形成盐的酸越弱,盐水解程度就越大。消耗的离子浓度越大,当溶液达到平衡时,剩余的离子浓度就越小。由于H2SO3的Ki2=1.02×10-7,HClO的Ki1=2.95×10-8,所以酸性:HSO3->HClO,因此溶液的pH: NaClO> Na2SO3。

 阅读快车系列答案
阅读快车系列答案