题目内容
2.下列排列顺序完全正确的组合是( )①溶解性:Na2CO3>NaHCO3>MgCO3>Mg(OH)2
②等浓度的下列盐溶液的pH关系:NaAlO2>NaHCO3>NaClO
③常温下,以a1、a2、a3分别表示pH=2的盐酸、pH=12的氨水、pH=12的碳酸钠溶液中水的电离程度,则a1=a2>a3
④同温下,1L0.5mol/LNH4Cl溶液中n(NH4+)与2L 0.25mol/LNH4Cl溶液中n(NH4+),分别为a、b,则a>b
⑤热稳定性:H2O>H2Se>H2S
⑥半径:Cl->O2->Al3+;F<Si<Na
⑦氧化性:MnO2>Cl2>Fe3+>Cu2+
⑧沸点:金刚石>氯化钠>干冰>冰醋酸.
| A. | ①②③④⑥ | B. | ①③④⑥⑦⑧ | C. | ②⑤⑧ | D. | ①④⑥⑦ |
分析 ①溶解度:Na2CO3<NaHCO3,钠盐易溶于水,卤化银AgX(X=F,Cl,Br,I)中AgF易溶,AgI、AgBr、AgCl难溶于水,溶解度大小AgI<AgBr<AgCl<AgF(易溶);
②阴离子的水解程度越大,则盐溶液的碱性越强;
③pH=2的盐酸中氢氧根离子为水电离,pH=12的氨水中氢离子是水电离的,pH=12的碳酸钠溶液中氢氧根离子是水的电离的,根据水电离的离子浓度比较水的电离程度;
④NH4+发生水解,NH4+浓度越小水解沉淀越大,但水解程度很小,溶液中NH4+数目取决于溶液体积与NH4+的浓度;
⑤元素的非金属性越强,氢化物的稳定性越强;
⑥电子层越多,半径越大,电子层相同,核电荷数越多半径越小;
⑦结合方程式,利用氧化剂氧化性强于氧化产物氧化性判断;
⑧干冰为分子晶体,熔沸点最低.
解答 解:①溶解度:Na2CO3<NaHCO3,钠盐易溶于水,卤化银AgX(X=F,Cl,Br,I)中AgF易溶,AgI、AgBr、AgCl难溶于水,溶解度大小AgI<AgBr<AgCl<AgF(易溶),所以溶解度Na2CO3>NaHCO3>AgCl>AgI,故正确.
②等浓度的下列盐溶液的pH关系:NaHCO3>NaAlO2>NaClO,故错误;
③pH=2的盐酸中氢氧根离子为水电离,氢氧根离子浓度为10-12mol/L,pH=12的氨水中氢离子是水电离的,氢离子浓度为10-12mol/L,pH=12的碳酸钠溶液中氢氧根离子是水的电离的,氢氧根离子浓度为10-2mol/L,所以水的电离程度为pH=2的盐酸等于pH=12的氨水小于pH=12的碳酸钠溶液,即α1=α2<α3,故错误;
④NH4+发生水解,NH4+浓度越小水解沉淀越大,溶液中NH4+数目取决于溶液体积与NH4+的浓度,所以溶液中a>b,故正确;
⑤元素的非金属性越强,氢化物的稳定性越强,所以热稳定性:H2O>H2S>H2Se,故错误;
⑥电子层越多,半径越大,电子层相同,核电荷数越多半径越小,半径:Cl->O2->Al3+;F<Si<Na,故正确;
⑦二氧化锰氧化Cl元素为氯气,所以氧化性MnO2>Cl2,氯气氧化铁为氯化铁,所以氧化性Cl2>Fe3+,铁离子氧化铜为铜离子,所以氧化性Fe3+>Cu2+,所以氧化性MnO2>Cl2>Fe3+>Cu2+,故正确;
⑧给定的物质中,干冰为分子晶体,熔沸点最低,故错误;
故选D.
点评 本题考查物质溶解性、氧化性强弱比较、盐类水解与弱电解质电离等,综合性较大,难度中等,注意A选项中的特殊性,对基础知识多加记忆

| A. | 是两种核素 | B. | 互为同素异形体 | ||
| C. | 中子数分别为176和177 | D. | 电子数相等 |
| A. | c(H+)/c(OH-)=1012的溶液中:NH${\;}_{4}^{+}$、Al3+、NO${\;}_{3}^{-}$、Cl- | |
| B. | 由水电离的c(H+)=1×10-14mol•L-1的溶液中:Ca2+、K+、Cl-、F- | |
| C. | pH=7的溶液中:K+、CO32-、SO42-、Cl- | |
| D. | pH=1的溶液中:Fe2+、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$、Na+ |
| A. | 溶液与胶体:不同的本质原因是否发生丁达尔效应 | |
| B. | 纯净物与混合物:是否仅含有一种元素 | |
| C. | 氧化还原反应:元素化合价是否变化 | |
| D. | 电解质与非电解质:物质本身的导电性 |
| A. | 电解质:CO2、Ca(OH)2、H2O、HNO3 | B. | 碱:NaOH、Ba(OH)2、Na2CO3、NH3•H2O | ||
| C. | 碱性氧化物:CaO、Na2O、FeO、Mn2O7 | D. | 盐:NH4NO3、KAl(SO4)2、NH4Cl、NaHCO3 |
| A. | 0.56L | B. | 1.12L | C. | 2.24L | D. | 3.36L |
| A. | HNO3 | B. | 无水乙醇 | C. | 石灰水 | D. | 盐酸 |
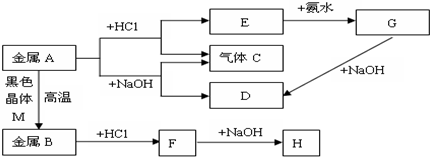
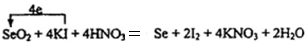 .
.