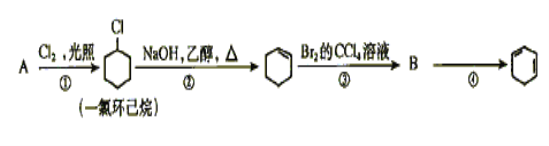
题目内容
【题目】碳、硫的含量影响钢铁性能。某兴趣小组用如下流程对钢样进行探究。
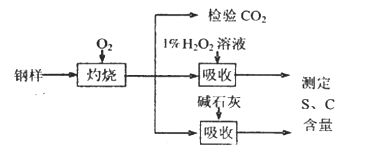
(1)钢样中硫元素以FeS形式存在,FeS在足量氧气中灼烧,生成的固体产物中Fe、O两种元素的质量比为21:8,则该固体产物的化学式为_____________。
(2)检验钢样灼烧生成气体中的CO2,需要的试剂是____________ (填字母)。
a.酸性KMnO4溶液 b.澄清石灰水 c.饱和小苏打溶液 d.浓H2SO4
(3)取10.00 g钢样在足量氧气中充分灼烧,将生成的气体用足量1%的H2O2溶液充分吸收,再用0.1000 mol·L-1NaOH溶液滴定吸收液至终点,消耗NaOH溶液20.00mL;另取10.00g钢样在足量氧气中充分灼烧,将生成的气体通过盛有足量碱石灰的U型管(如下图),碱石灰增重0.614 g。
①用l%H2O2溶液吸收SO2,发生反应的离子方程式为___________________。
②分别计算该钢样中硫、碳元素的质量分数(写出计算过程)。
③实验测得的碳元素质量分数比真实值偏高,其可能的原因是______________(填字母)
a.U型管中生成的亚硫酸盐吸收了O2
b.碱石灰吸收了空气中的CO2
c.气体通过碱石灰的流速过快,末被充分吸收
【答案】 Fe3O4 ab H2O2+SO2═2H++SO42- n(S)= n(SO2)= ![]() n(NaOH)
n(NaOH)
=1/2×0.02000L×0.1000mol·L-1=1.000×10-3mol
w(S)= ![]() ×100%=0.32%
×100%=0.32%
m(CO2)=0.614- m(SO2)=0.550g
n(C)= n(CO2) =![]() =0.0125mol
=0.0125mol
w(C)= ![]() ×100%=1.5%
×100%=1.5%
ab
【解析】(1) 生成的固体产物中Fe、O两种元素的质量比为21:8,则Fe、O两种元素的物质的量之比为![]() :
: ![]() =
=![]() ,则该固体产物的化学式为Fe3O4,故答案为:Fe3O4;
,则该固体产物的化学式为Fe3O4,故答案为:Fe3O4;
(2)钢样灼烧生成气体中含有CO2和SO2,二氧化硫也能够使澄清石灰水变浑浊,因此需要用酸性KMnO4溶液反应除去二氧化硫后再用澄清石灰水检验,故答案为:ab;
(3)①用l%H2O2溶液吸收SO2,将二氧化硫氧化生成硫酸,反应的离子方程式为H2O2+SO2═2H++SO42-,故答案为:H2O2+SO2═2H++SO42-;
②n(S)= n(SO2)= ![]() n(NaOH)=1/2×0.02000L×0.1000mol·L-1=1.000×10-3mol ,w(S)=
n(NaOH)=1/2×0.02000L×0.1000mol·L-1=1.000×10-3mol ,w(S)= ![]() ×100%=0.32% ,m(CO2)=0.614- m(SO2)=0.550g ,n(C)= n(CO2) =
×100%=0.32% ,m(CO2)=0.614- m(SO2)=0.550g ,n(C)= n(CO2) =![]() =0.0125mol ,w(C)=
=0.0125mol ,w(C)= ![]() ×100%=1.5% ,故答案为:1.5%;
×100%=1.5% ,故答案为:1.5%;
③a.U型管中生成的亚硫酸盐吸收了O2,导致碱石灰增重偏大,测得的二氧化碳偏大,碳元素质量分数比真实值偏高,正确;b.碱石灰吸收了空气中的CO2,导致碱石灰增重偏大,测得的二氧化碳偏大,碳元素质量分数比真实值偏高,正确;c.气体通过碱石灰的流速过快,末被充分吸收,导致碱石灰增重偏小,测得的二氧化碳偏小,碳元素质量分数比真实值偏低,错误;故选ab。

 寒假学与练系列答案
寒假学与练系列答案