题目内容
【题目】为了探究原电池和电解池的工作原理,某研究性学习小组分别用下图所示的装置进行实验。据图回答问题。

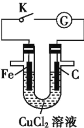
I.用图甲所示装置进行第一组实验时:
(1)在保证电极反应不变的情况下,不能替代Cu作电极的是_____ (填字母)。
A石墨 B. 镁 C.银 D.铂
(2)实验过程中,SO42-____(填“从左向右”“从右向左”或“不”)移动;滤纸上能观察到的现象是________________。
II.该小组同学用图乙所示装置进行第二组实验时发现,两极均有气体产生,且Y极处溶液逐渐变成紫红色;停止实验观察到铁电极明显变细,电解液仍然澄清。查阅资料知,高铁酸根(FeO42-)在溶液中呈紫红色。请根据实验现象及所查信息,回答下列问题:
(3)电解过程中,X极处溶液的OH-浓度____(填“增大”“减小”或“不变)。
(4)电解过程中,Y极发生的电极反应为___________________,_________________。
(5)电解进行一段时间后,若在Y电板(铁电极)质量减小2.8g,在Y极收集到气体为1.68 L 则X极收集到气体__________L(均己折算为标准状况时气体体积)。
(6)K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电池反应总反应式为2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的电极反应式为_______________。
【答案】B 从右向左 滤纸上有蓝色沉淀产生(答出“蓝色沉淀”或“蓝色斑点”即可) 增大 4OH--4e-=2H2O+O2↑ Fe-6e-+8OH-=FeO42-+4H2O 6.72 2FeO42-+6e-+5H2O=Fe2O3+10OH-
【解析】
I.(1)甲装置中左侧为原电池装置,锌作负极,铜作正极,由于需保证电极反应不变,故正极材料的活泼性不能大于Zn,因此不能用镁代替铜;
(2)硫酸根离子向负极移动,移动方向为从右向左移动,M极作阳极,失去电子有铜离子生成,铜离子结合氢氧根离子生成氢氧化铜沉淀;
II.(3)X极作阴极,X极上发生反应:2H++2e-=H2↑,破坏了水的电离平衡,水继续电离,最终导致溶液的c(OH-)增大;
(4)在电解过程中,Y极发生的电极反应为4OH--4e-=2H2O+O2↑和Fe-6e-+8OH-=FeO42-+4H2O;
(5)根据整个电路中电子转移数目相等进行计算;
(6)K2FeO4-Zn碱性电池中,Zn作负极,负极的电极反应式为3Zn-6e-+6OH-=3Zn(OH)2,总电池反应:2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2。用总反应式—负极电极式可得:该电池正极发生的电极反应式为:2FeO42-+6e-+5H2O=Fe2O3+10OH-。
I.(1)甲装置是原电池,Zn作负极,Cu作正极。若要保证电极反应不变,则另一个电极的活动性只要比Zn弱即可。根据金属活动性顺序,Mg>Zn,不能是Mg,故答案为:B。
(2)根据同种电荷相互排斥,异种电荷相互吸引的原则,实验过程中,SO42-会向正电荷较多的Zn电极方向移动。即从右向左移动。此时由于在阳极上发生反应Cu-2e-=Cu2+,产生的Cu2+在溶液中发生反应Cu2++2OH-=Cu(OH)2↓,所以在滤纸上能观察到的现象是有蓝色沉淀产生,故答案为:从右向左,滤纸上有蓝色沉淀产生(答出“蓝色沉淀”或“蓝色斑点”即可)。
II.(3)由图可知:X为阴极。电解过程中,X极上发生反应:2H++2e-=H2↑,破坏了水的电离平衡,水继续电离,最终导致溶液的c(OH-)增大,故答案为:增大。
(4)根据已知条件可知:在电解过程中,Y极发生的电极反应为4OH--4e-=2H2O+O2↑和Fe-6e-+8OH-=FeO42-+4H2O,故答案为:4OH--4e-=2H2O+O2↑,Fe-6e-+8OH-=FeO42-+4H2O。
(5)根据条件可知:n(O2)=1.68L÷22.4L/mol=0.075mol,在整个电路中电子转移数目相等,2n(H2)=4×n(O2)+6×(2.8g÷56g/mol)=0.6mol,n(H2)=0.3mol,即V(H2)=0.3mol×22.4L/mol=6.72L,故答案为:6.72。
(6)K2FeO4-Zn也可以组成碱性电池,Zn作负极,负极的电极反应式为3Zn-6e-+6OH-=3Zn(OH)2,K2FeO4在电池中作为正极材料,电池反应:2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2。用总反应式—负极电极式可得:该电池正极发生的电极反应式为:2FeO42-+6e-+5H2O=Fe2O3+10OH-,故答案为:2FeO42-+6e-+5H2O=Fe2O3+10OH-。

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案