题目内容
将0.2mol丁烷完全燃烧后生成的气体全部缓慢通入0.5L2mol/LNaOH溶液中,生成的Na2CO3和NaHCO3的物质的量之比为
| A.3:2 | B.2:3 | C.2:1 | D.l:3 |
D
解析试题分析:0.2mol的丁烷完全燃烧生成0.8molCO2,与0.5L×2mol/L=1mol的NaOH溶液完全反应,生成的Na2CO3和NaHCO3的物质的量设为x、y,根据元素守恒,可得x+y=0.8mol,2x+y=1mol,解得x=0.2mol,y=0.6mol,所以x:y=1:3,答案选D。
考点:考查计算过程中守恒法的应用,二氧化碳的性质

下列物质中,属于芳香烃且属于苯的同系物的是( )
A.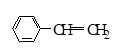 | B. | C. | D. |
由乙炔(C2H2)、苯和甲醛(CH2O)组成的混和物中,测得含碳元素的质量百分含量为72%,则混和物中氧元素的质量百分含量为
| A.20.7% | B.22% | C.24.9% | D.28% |
下列液体中,滴入水中会出现分层现象,但在滴入热的氢氧化钠溶液中时分层现象会逐渐消失的是(不考虑有机物的挥发)
| A.溴乙烷 | B.乙醇 |
| C.橄榄油 | D.苯乙烯 |
为了减少城市空气污染,要求使用无铅汽油,所谓无铅汽油是指( )
| A.不用铅桶装的汽油 | B.不含四乙基铅的汽油 |
| C.不含Pb(NO3)2的汽油 | D.不含氧化铅的汽油 |
下列实验中,不能达到预期目的是
①苯、浓溴水、溴化铁混合制溴苯
②乙醇和30%的硫酸共热到170℃制乙烯
③用溴水除去混在苯中的己烯,分液得到纯净的苯
④敞口久置的电石与饱和食盐水混合制乙炔
⑤将电石与水反应产生的乙炔通入溴水中,溴水褪色,证明乙炔和溴水发生了加成反应
⑥将溴乙烷和NaOH乙醇溶液混合共热,生成的气体直接通入酸性高锰酸钾溶液,酸性高锰酸钾溶液褪色,说明有乙烯生成
| A.②④⑥ | B.①③⑤ | C.①②④⑥ | D.①②③④⑤⑥ |
要检验己烯中是否混有少量甲苯,正确的实验方法是
| A.先加足量的酸性高锰酸钾溶液,然后再加入溴水 |
| B.点燃这种液体,然后再观察火焰的颜色 |
| C.先加足量溴水,然后再加入酸性高锰酸钾溶液 |
| D.加入浓硫酸与浓硝酸后加热 |
煤和石油中的硫燃烧产生的二氧化硫是形成硫酸型酸雨的主要原因,因此要对煤和石油等燃料进行脱硫处理,对应的下列说法正确的是( )
| A.在煤中添加的脱硫剂是石灰石 |
| B.在煤中添加的脱硫剂是熟石灰 |
| C.脱硫后产生的废料中含有的CaCO3可用于制造建筑材料 |
| D.脱硫后产生的废料中含有的CaSO3,可用于制造建筑材料 |
利用下列反应不能制得括号中纯净物质的是
| A.乙烯与水反应(乙醇) |
| B.乙烯与氯气反应(1,2-二氯乙烷) |
| C.液溴与苯用溴化铁作催化剂反应(溴苯) |
| D.等物质的量的氯气与乙烷在光照条件下反应(氯乙烷) |