题目内容
电解普通水和重水(
H2O)的混合物,通电一段时间后,两级共生成气体18.5g,体积为33.6L(标况下).求所生成的气体中氕和氘的原子个数比是多少.
2 1 |
考点:质量数与质子数、中子数之间的相互关系,电解原理
专题:计算题
分析:先根据氢气和氧气的体积之比为2:1,从而计算出氢气和氧气的体积以及物质的量,利用氧气的体积计算氧气的质量,再利用平均摩尔质量法计算普通氢和重氢的物质的量之比,结合分子构成计算普通氢和重氢的原子个数之比即可.
解答:
解:电解水的方程式为2H2O
2H2↑+O2↑,由方程式知,氢气和氧气的体积之比为2:1,
即氢气的体积为22.4L,氢气的物质的量为1mol;氧气的体积为11.2L,氧气的质量=
×32g/mol=16g;氢气的质量为2.5g,所以氢气的平均摩尔质量=
=2.5g/mol,普通氢和重氢的物质的量之比为: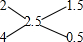 1.5:0.5=3:1,普通氢和重氢都是双原子分子,所以普通氢和重氢的原子个数之比为3:1;
1.5:0.5=3:1,普通氢和重氢都是双原子分子,所以普通氢和重氢的原子个数之比为3:1;
答:生成的气体中氕和氘的原子个数比是3:1.
| ||
即氢气的体积为22.4L,氢气的物质的量为1mol;氧气的体积为11.2L,氧气的质量=
| 11.2L |
| 22.4L/mol |
| 2.5g |
| 1mol |
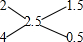 1.5:0.5=3:1,普通氢和重氢都是双原子分子,所以普通氢和重氢的原子个数之比为3:1;
1.5:0.5=3:1,普通氢和重氢都是双原子分子,所以普通氢和重氢的原子个数之比为3:1;答:生成的气体中氕和氘的原子个数比是3:1.
点评:本题以电解原理为载体考查了物质的量的有关计算,难度不大,充分利用平均摩尔质量法是解答本题的关键

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列气体中的主要成分不是甲烷的是( )
| A、空气 | B、沼气 |
| C、天然气 | D、水煤气 |
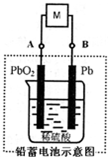 如图铅蓄电池是一种典型的可充电电池,电池总反应式为
如图铅蓄电池是一种典型的可充电电池,电池总反应式为Pb+PbO2+4H++2SO42-
| 放电 |
| 充电 |
| A、放电时,电流方向由B过M到A |
| B、充电时,铅蓄电池的正极应与充电器电源的负极相连 |
| C、放电时,正极反应是Pb-2e-+SO42-═PbSO4 |
| D、充电时,阳极反应是PbSO4-2e-+2H2O═PbO2+SO42-+4H+ |
下列书写的离子方程式中,正确的是( )
| A、高锰酸钾溶液与乙二酸(草酸)反应:2MnO4-+5C2O42-+16H+→2Mn2++10CO2↑+8H2O |
| B、在NH4HSO4溶液中慢慢滴入等物质的量的NaOH溶液:NH4++OH-→NH3?H2O |
| C、VO2+与酸性高锰酸钾溶液反应:5VO2++MnO4-+H2O→5VO2++Mn2++2H+ |
| D、Fe2+离子被空气氧化:4Fe2++O2+2H2O→4Fe3++4OH- |
 实验室制取乙烯的装置如图所示,请回答:
实验室制取乙烯的装置如图所示,请回答: