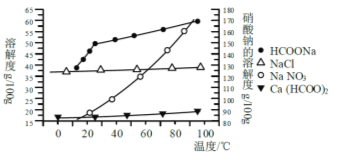
题目内容
【题目】科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4。下列关于该电池叙述错误的是( )
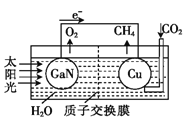
A.电池工作时,是将太阳能转化为电能
B. 铜电极为正极,电极反应式为:CO2+8e-+8H+=CH4+2H2O
C.电池内部H+透过质子交换膜从左向右移动
D.为提高该人工光合系统的工作效率,可向装置中加入少量硝酸溶液
【答案】D
【解析】
试题分析:A.根据图示可知,该装置中将太阳能转化为电能的过程,A正确;B.根据电子流向知,Cu是正极,正极上二氧化碳得电子和氢离子反应生成甲烷,电极反应式为:CO2+8e-+8H+=CH4+2H2O,B正确;C.放电时,电解质溶液中阳离子向正极移动,所以装置中的H+由左向右移动,C正确;D.可向装置中加入少量的酸作电解质,由于硝酸易挥发,生成的甲烷中会混有硝酸气体,应加入硫酸,D错误;答案选D。

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目