题目内容
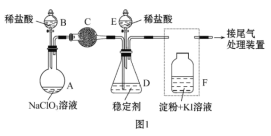
【题目】二氯化二硫(S2Cl2)是一种常用于橡胶硫化、有机物氯化的试剂,甲同学查阅资料:①将干燥的氯气在110~140 ℃ 间与硫反应,即可得S2Cl2粗品;②有关物质的部分性质如表所示:
物质 | 熔点/℃ | 沸点/℃ | 化学性质 |
S | 112.8 | 444.6 | 略 |
S2Cl2 | -77 | 137 | ①一种橙黄色的液体,遇水易水解,有淡黄色固体出现,同时产生能使品红溶液褪色的气体。 ②300 ℃以上完全分解。③S2Cl2+Cl2=2SCl2 |
设计如图所示实验装置在实验室合成S2Cl2:
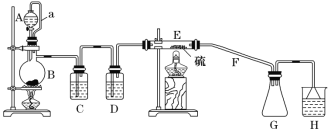
回答以下问题:
(1)仪器A的名称是_______________。
(2)B中所发生反应的离子方程式为___________________________________。
(3)C装置的作用是___________________________________ 。
(4)S2Cl2粗品中可能混有的杂质是_______________ (写其中一种,填化学式)。
(5)乙同学发现,该装置中除了E处的温度不能过高外,还有一处重大缺陷需改进,否则会导致S2Cl2的产率大大降低,原因是______________________________ (用化学方程式表示);请简要提出改进方案:________________________________________________。
(6)H中的溶液可以选择下列试剂中的__________ (填字母)。
A 碳酸钠溶液 B 氯化铁溶液 C 高锰酸钾溶液 D 亚硫酸钠溶液
【答案】分液漏斗 MnO2+4H++2Cl- ![]() Mn2++Cl2↑+2H2O 除去Cl2中的HCl杂质 SCl2或S或Cl2 2S2Cl2+2H2O=3S↓+SO2↑+4HCl 在G和H之间增加干燥装置(如盛有浓硫酸的洗气瓶) AD
Mn2++Cl2↑+2H2O 除去Cl2中的HCl杂质 SCl2或S或Cl2 2S2Cl2+2H2O=3S↓+SO2↑+4HCl 在G和H之间增加干燥装置(如盛有浓硫酸的洗气瓶) AD
【解析】
实验目的是制备S2Cl2,实验原理:2S+Cl2![]() S2Cl2,从左向右依次为制气装置→除杂装置→干燥装置→反应装置→收集装置→尾气处理装置,结合题中信息,据此判断;
S2Cl2,从左向右依次为制气装置→除杂装置→干燥装置→反应装置→收集装置→尾气处理装置,结合题中信息,据此判断;
(1)根据仪器A的特点,仪器A为分液漏斗;
(2)制备S2Cl2,用S和Cl2反应,B装置的作用是制备Cl2,其离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(3)S和Cl2反应需要干燥的氯气,B装置中制备的氯气中含有HCl和水蒸气,装置C盛放饱和食盐水,其作用是除去氯气中的氯化氢,装置D盛放浓硫酸,其作用是干燥氯气;
(4)根据信息,S2Cl2与Cl2发生反应生成SCl2,即S2Cl2中混有SCl2,也可能会混有S和Cl2;
(5)S2Cl2遇水易水解,因此需要氯气是干燥的,同时装置H中水蒸气不能进入反应装置中,根据装置图,连接G和H之间没有干燥装置,装置H中的水蒸气进入G中,发生2S2Cl2+2H2O=3S↓+SO2↑+4HCl;改进方案是在G和H之间增加干燥装置;
(6)氯气有毒,需要尾气处理装置,即H的作用是吸收多余的氯气,FeCl3和KMnO4都不与氯气发生反应,氯气溶于水生成HCl和HClO,能与Na2CO3发生反应,Na2SO3具有还原性,能与氯气发生氧化还原反应,可以选择AD。

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案