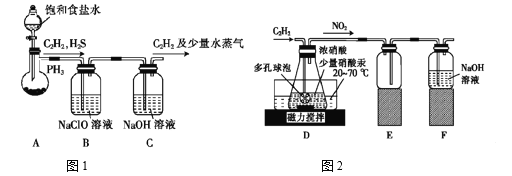
题目内容
【题目】A、B均为钾盐的水溶液,A呈中性,B有氧化性,E的溶质中有一种含+5价元素的含氧酸盐M。现有下图所示转化:
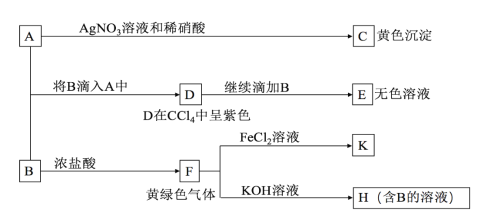
请回答:
(1)C的化学式为_________,检验气体F常用的试纸是______________
(2)写出物质M在生活中的常见用途______________
(3)写出F→H的化学方程式:______________
【答案】AgI (湿润的)淀粉—碘化钾试纸 给食盐中加碘、给人体补充碘元素、预防甲状腺肿大等 Cl2+2KOH=KCl+KClO+H2O
【解析】
A为钾盐且遇到硝酸酸化的AgNO3得到黄色沉淀,说明A为KI;D在CCl4中呈紫色,说明D为I2;将B逐滴加入KI溶液中即可将I-氧化为I2,说明该钾盐具有强氧化性, F(黄绿色气体)为Cl2,与KOH溶液反应会生成KCl和KClO,而KClO具有氧化性,又H中含B,故H中B为KClO,上述流程中,得到的碘溶液,继续滴加KClO会继续发生氧化还原反应,KClO继续将I2氧化为IO3-,溶液变为无色,结合已知信息,E的溶质中有一种含+5价元素的含氧酸盐M,则M为KIO3;氯气可氧化氯化亚铁为氯化铁,故K为FeCl3,据此分析作答。
根据上述分析可知,
(1)C为黄色沉淀,其化学式为AgI,F为氯气,检验气体氯气常用的试纸是(湿润的)淀粉—碘化钾试纸,故答案为:AgI;(湿润的)淀粉—碘化钾试纸;
(2)根据上述分析知,M为KIO3,在生活中的常见用途是:给食盐中加碘、给人体补充碘元素、预防甲状腺肿大等
(3)F→H为氯气与氢氧化钾的反应,其化学方程式为:Cl2+2KOH=KCl+KClO+H2O。

 智能训练练测考系列答案
智能训练练测考系列答案【题目】“绿水青山就是金山银山”。目前人们对环境保护、新能源开发很重视,研究NO2、NO、CO、SO2等大气污染物转化为能参与大气循环的物质,对建设美丽中国具有重要意义。
(1)有人设计通过硫循环完成CO的综合处理,原理为
a.2CO(g)+SO2(g)![]() S(l)+2CO2(g) △H1=37.4kJ·mol-1
S(l)+2CO2(g) △H1=37.4kJ·mol-1
b.S(l)+2H2O(g)![]() 2H2(g)+SO2(g) △H2=-45.4 kJ·mol-1
2H2(g)+SO2(g) △H2=-45.4 kJ·mol-1
则CO和水蒸气完全反应生成H2和CO2的热化学方程式为______。
(2)CO可在一定条件下转化为CH3OH。已知:向2L密闭容器中通入2 molCO和4molH2,在适合的催化剂和T1温度下,发生反应CO(g)+2H2(g)![]() CH3OH(g) △H<0,10min时达到平衡状态,10min后改变温度为T2,20min时达到平衡状态,反应过程中部分数据见表:
CH3OH(g) △H<0,10min时达到平衡状态,10min后改变温度为T2,20min时达到平衡状态,反应过程中部分数据见表:
反应时间 | CO(mol) | H2(mol) | CH3OH(mol) |
0min | 2 | 4 | 0 |
10min | 2 | ||
20min | 0.2 |
①前10min内的平均反应速率v(CO)=______;在20min时,温度T2下,该反应的化学平衡常数为_______。
②若30min时升高温度,化学平衡常数值_______(填:“增大“减小”“不变”)。
③在T1温度下,既能增大反应速率和提高CO平衡转化率的措施有_______(填两种措施即可)
④在恒温恒容下,下列可以判断CO(g)+2H2(g)![]() CH3OH(g)反应达到平衡状态的_____(填序号)。
CH3OH(g)反应达到平衡状态的_____(填序号)。
a.2v正(H2)=v逆(CH3OH)
b.混合气体的物质的量不再变化
c.单位时间内有1 mol CO消耗同时消耗2molH2
d.混合气体的平均相对分子质量不变
(3)已知反应2NO(g)+O2(g)![]() 2NO2的正反应速率v正=k1Cm(NO)Cn(O2
2NO2的正反应速率v正=k1Cm(NO)Cn(O2

则k1=____,m=_____,n=_____。