题目内容
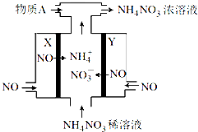
【题目】(1)如图所示装置,总反应的离子方程式为_________________________。
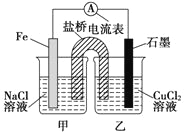
(2)质量相等的两电极反应后质量相差12 g,则导线中通过了____________mol 电子。
(3)其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式_____________________,这是由于NH4Cl溶液显__________ (填“酸性”“碱性”或“中性”),用离子方程式表示溶液显此性的原因____________________。
【答案】(1)Fe+ Cu2+ = Fe2+ + Cu
(2)0.2
(3)2H++2e- =H2↑;酸性;NH4++H2O![]() NH3·H2O+H+
NH3·H2O+H+
【解析】
试题分析:(1)根据装置图可知该电池工作时铁电极做负极,发生氧化反应,铜离子在正极发生还原反应,所以总反应的离子方程式为:Fe+ Cu2+ = Fe2+ + Cu。
故答案为:Fe+ Cu2+ = Fe2+ + Cu;
(2)根据Fe+ Cu2+ = Fe2+ + Cu可知,当导线中通过2mol电子时,两电极质量差为56g+64g=120g,所以质量相等的两电极反应后质量相差12 g,则导线中通过了0.2mol电子。
故答案为:0.2;
(3)其他条件不变,若将CuCl2溶液换为NH4Cl溶液,正极为氢离子得到电子生成氢气,所以石墨电极反应式为:2H++2e- =H2↑;这是由于NH4Cl溶液发生水解:NH4++H2O![]() NH3·H2O+H+使溶液显酸性引起的。
NH3·H2O+H+使溶液显酸性引起的。
故答案为:2H++2e- =H2↑;酸性;NH4++H2O![]() NH3·H2O+H+。
NH3·H2O+H+。

练习册系列答案
相关题目