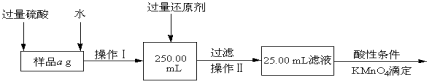
��Ŀ����
����Ŀ��X��Y��Z��R��M��ԭ�������������������Ԫ�أ���̬Xԭ�ӵ�s��������p��������3����Y��Zͬ���������ڣ���һ�����ܣ�Y��Z��Z��Rͬ���壬M���������29���˶�״̬����ش��������⣺
��1��������XCl3������ԭ���ӻ�����Ϊ___________��RCl2�����幹��Ϊ___________��
��2��H2Z��H2R�ķе�ֱ�Ϊ100����-60��4�����Խ�����ԭ��___________________��
��3��H2RO3��K1��K2�ֱ�Ϊ1��54��10-2��1��02��10-7������ݽṹ�����ʵĹ�ϵ����K1��K2��ԭ��___________________��
��4��Z��M�γɵ�һ�ֻ����ᄃ����ͼ��ʾ��

���û�����Ļ�ѧʽΪ________________��
������������Ϊapm����ʽ����þ������ܶ���=_____________gcm-3��
���𰸡���1��sp2V��
��2��H2O���Ӽ�����γ������H2S���Ӽ䲻���γ����
��3��SO32-��H+��Ľ������ǿ��HSO3-��H+��Ľ����������H2SO3��HSO3-����������ӣ�����̶ȴ�ӦKֵ��
��4����Cu2O ��![]()
�����������������X��Y��Z��R��M��ԭ������������������Ԫ�أ�M���������29���˶�״̬����MΪCu����̬Xԭ�ӵ�s��������p��������3����ԭ�Ӻ�������Ų�ʽΪ1s22s22p1����XΪBԪ�أ������ڱ���Y��Z�����ҵ�һ������Y��Z��Z��Rͬ���壬��Y�����������A�壬���ԭ��������֪����Y������A�壬R��ԭ����������Cu�����������⣬��YΪNԪ�ء�ZΪOԪ�ء�RΪSԪ�أ�
��1��������BCl3��Bԭ�ӹµ��Ӷ���=![]() =0���۲���Ӷ���=3+0=3��Bԭ�Ӳ�ȡsp2�ӻ���SCl2�۲���Ӷ���Ϊ
=0���۲���Ӷ���=3+0=3��Bԭ�Ӳ�ȡsp2�ӻ���SCl2�۲���Ӷ���Ϊ![]() =4���µ��Ӷ���Ϊ
=4���µ��Ӷ���Ϊ![]() =2�������ӻ�����Ϊsp3�ӻ�������ΪV�νṹ��
=2�������ӻ�����Ϊsp3�ӻ�������ΪV�νṹ��
��2��H2O���Ӽ�����γ������H2S���Ӽ䲻���γ��������ˮ�ķе������ߣ�
��3��SO32-��H+��Ľ������ǿ��HSO3-��H+��Ľ����������H2SO3��HSO3-����������ӣ�����̶ȴ�ӦKֵ��
��4���������к�ɫ��Ϊ4����ɫ����ĿΪ1+8��=2��ԭ����Ŀ֮��Ϊ2��1����Cu��O�γɵĻ�����ΪCu2O��
����������Ϊ2��![]() g�����ܶ�Ϊ2��
g�����ܶ�Ϊ2��![]() g����a��10-10cm��3=
g����a��10-10cm��3=![]() ��
��