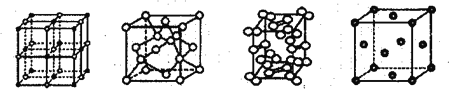
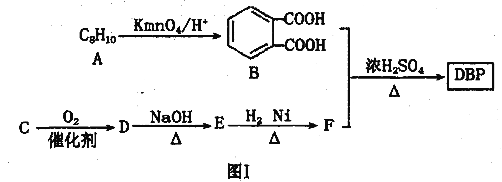
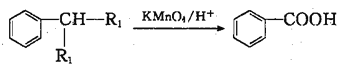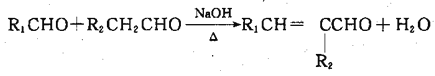题目内容
【题目】下列实验事实不能用平衡移动原理解释的是
A. 90 oC,纯水的pH<7
B. 黄绿色的氯水光照后颜色变浅
C. 氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深
D. 重铬酸钾溶液中滴加氢氧化钠溶液,溶液由橙色变黄色
【答案】C
【解析】
其它条件下不变,改变影响化学平衡的一个条件,平衡向着能够减弱这种改变的方向移动,此规律研究的平衡移动规律,对于没有达平衡的反应,反应前后气体总量不变的反应此规律不适用。
水是弱电解质,升高温度,使电离平衡正向移动,会促进水的电离,c(H+)、c(OH-)增大,pH<7,能用平衡移动原理解释,A错误;氯水中存在平衡Cl2+H2O![]() HCl+HClO,次氯酸受光照射会分解,次氯酸浓度减小,平衡向右移动,所以颜色变浅,能用平衡移动原理解释,B错误;存在平衡H2+Br2
HCl+HClO,次氯酸受光照射会分解,次氯酸浓度减小,平衡向右移动,所以颜色变浅,能用平衡移动原理解释,B错误;存在平衡H2+Br2![]() 2HBr(g),该反应前后气体的体积不变,增大压强,平衡不移动,增大平衡体系的压强气体的体积减小,Br2的浓度增大,所以颜色变深,不能用平衡移动原理解释,C正确;加入氢氧化钠,氢离子浓度降低,平衡Cr2O72-(橙红色)+H2O
2HBr(g),该反应前后气体的体积不变,增大压强,平衡不移动,增大平衡体系的压强气体的体积减小,Br2的浓度增大,所以颜色变深,不能用平衡移动原理解释,C正确;加入氢氧化钠,氢离子浓度降低,平衡Cr2O72-(橙红色)+H2O![]() 2H++2CrO42-(黄色)向正向移动,能用勒夏特列原理解释,D错误;正确选项C。
2H++2CrO42-(黄色)向正向移动,能用勒夏特列原理解释,D错误;正确选项C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】在2 L密闭容器内,800 ℃时NO(g)和O2(g)反应生成NO2(g)的体系中,n(NO)随时间的变化如下表所示:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应________(填“是”或“不是”)可逆反应,在第5 s时,NO的转化率为________。
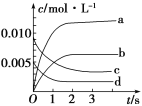
(2)如图,表示NO2变化曲线的是____,用O2表示从0~2 s内该反应的平均速率v=________。
(3)能使该反应的反应速率增大的是________。
a.及时分离出NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效的催化剂