题目内容
下列叙述不正确的是( )A.锌跟稀硫酸反应制取氢气,加入少量的硫酸铜能加快反应速率
B.镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易被腐蚀
C.钢铁表面常易被锈蚀生成Fe2O3·nH2O
D.钢铁在发生析氢腐蚀和吸氧腐蚀时,完全相同的反应是负极反应
解析:A中锌与CuSO4发生置换反应,铜附着在锌的表面上,浸泡在稀硫酸中形成铜锌原电池,负极锌被氧化而加速反应,故A正确。B中镀锌铁构成原电池时锌为负极,铁为正极,铁被保护;镀锡铁构成原电池铁作负极,锡作正极,铁失电子加速了铁的腐蚀,故B不正确。C中钢铁的锈蚀主要是吸氧腐蚀,其电极反应为:负极(Fe):2Fe-4e-====2Fe2+ 正极(C):2H2O+O2+4e-====4OH-,形成Fe(OH)2,在空气中4Fe(OH)2+O2+2H2O====4Fe(OH)3,久置后2Fe(OH)3====Fe2O3+3H2O,所以铁锈的成分是Fe2O3·nH2O,故C不正确。D中钢铁在发生析氢腐蚀和吸氧腐蚀时,负极反应相同,都是Fe-2e-====Fe2+,但正极反应不同,分别析出氢气和吸收氧气,D也正确。
答案:B

练习册系列答案
相关题目
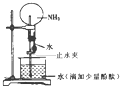 如图是实验室进行氨溶于水的“喷泉实验”的装置,下列叙述不正确的是( )
如图是实验室进行氨溶于水的“喷泉实验”的装置,下列叙述不正确的是( )| A、该实验说明氨气是一种极易溶于水的气体 | B、进入烧瓶中的液体颜色由无色变为红色,说明氨水有碱性 | C、氨水很稳定,将烧瓶中的红色溶液加热,颜色不会发生变化 | D、形成“喷泉”的主要原因是氨气溶于水后,烧瓶内的气压小于大气压 |
苯与乙烯相比较,下列叙述不正确的是( )
| A、都能燃烧,生成二氧化碳和水 | B、都容易发生加成反应 | C、乙烯易发生加成反应,苯只能在特殊条件下才发生加成反应 | D、乙烯易被酸性高锰酸钾溶液氧化,苯不能被酸性高锰酸钾溶液氧化 |