题目内容
用酸性氢氧燃料电池电解硫酸钠饱和溶液的装置如图所示 (a、b为铜电极).下列说法中不正确的是( )
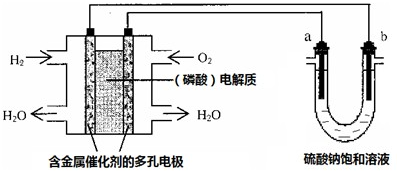

分析:左边装置是氢氧燃料电池,所以是原电池,原电池放电时,燃料失电子发生氧化反应,所以投放燃料的电极为负极,投放氧化剂的电极为正极,正极上氧化剂得电子发生还原反应;右边装置有外接电源,所以是电解池,连接负极的b电极是阴极,连接正极的a电极是阳极,阳极上失电子发生氧化反应,阴极上得电子发生还原反应;两电池工作时,电子的流动路径是:负极→外电路→阴极→溶液→阳极→正极.
解答:解:A、左边装置是氢氧燃料电池,所以是原电池;原电池放电时,正极上氧化剂得电子发生还原反应,即氧气得电子和氢离子反应生成水,电极反应式为O2+4H++4e-=2H2O,故A正确.
B、电解时,阴极上析出的是氢气,当阴极逸出amol气体电解的水的质量为:
2H2O
O2↑+2H2↑,
36g 2mol
18ag amol
所以当阴极逸出amol气体电解的水的质量为18ag,电解后的溶液仍为饱和溶液,溶液的质量分数为:
×100%=
×100%,故B错误.
C、电子在导线中移动,不能在溶液中移动,故C错误;
D、燃料电池和电解池中转移的电子数是相等的,当电池中消耗0.02gH2,根据电极反应:H2→2H++2e-,所以转移电子0.02mol,b极的电极反应为:2H++2e-→H2,转移电子0.02mol,会产生0.02gH2,故D正确.
故选BC.
B、电解时,阴极上析出的是氢气,当阴极逸出amol气体电解的水的质量为:
2H2O
| ||
36g 2mol
18ag amol
所以当阴极逸出amol气体电解的水的质量为18ag,电解后的溶液仍为饱和溶液,溶液的质量分数为:
| ||
| W+18a |
| 71W |
| 161(W+18a) |
C、电子在导线中移动,不能在溶液中移动,故C错误;
D、燃料电池和电解池中转移的电子数是相等的,当电池中消耗0.02gH2,根据电极反应:H2→2H++2e-,所以转移电子0.02mol,b极的电极反应为:2H++2e-→H2,转移电子0.02mol,会产生0.02gH2,故D正确.
故选BC.
点评:本题考查了原电池原理,易错选项是C,注意电子在导线中移动,不能在溶液中移动.

练习册系列答案
相关题目