题目内容
下列试验中,所选装置不合理的是
| A.粗盐提纯,选①和② |
| B.用CC14提取碘水中的碘,选③ |
| C.分离Na2CO3溶液和CH3COOC2H5,选④ |
| D.用FeC12溶液吸收C12选⑤ |
C
解析试题分析:本题主要考查常见实验操作及仪器选择,A、粗盐提纯过程中包含过滤与蒸发操作,选①和②合理;B、用CCl4提取碘,应选用萃取装置③,合理;C、由于Na2CO3溶液与CH3COOC2H5互不相溶,故应选用分液装置③,错误;D、用FeCl2溶液吸收Cl2,应选用洗气装置⑤,正确。
考点:考查化学实验基本操作和物质的分离与提纯

练习册系列答案
相关题目
从海水中提取镁的工业生产流程如下: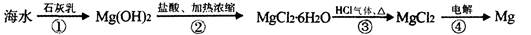
下列说法错误的是
| A.此法的优点之一是原料来源丰富 |
| B.该提取镁的过程中涉及置换、分解、复分解和氧化还原反应 |
| C.步骤①②③的目的是从海水中提取无水MgCl2 |
| D.步骤②中加盐酸的离子方程式为Mg(OH)2+2H+=Mg2++2H2O |
根据下列实验内容得出的结论正确的是
| 选项 | 实验内容 | 结论 |
| A | 某气体的水溶液能使红色石蕊试纸变蓝 | 该气体一定是NH3 |
| B | 某气体能使紫色的酸性高锰酸钾溶液褪成无色 | 该气体一定是SO2 |
| C | 某物质的水溶液中加入盐酸产生能使澄清石灰水变浑浊的无色气体 | 该溶液一定含有CO32- |
| D | 某物质的水溶液中加入BaCl2溶液,产生白色沉淀,再加入稀硝酸,沉淀不溶解 | 该溶液中至少含有SO42-、SO32-中的一种 |
物质制备过程中离不开物质的提纯。以下除杂方法不正确的是
| 选项 | 目的 | 实验方法 |
| A | 除去Na2CO3固体中的NaHCO3 | 置于坩埚中加热至恒重 |
| B | 除去NaCl中少量KNO3 | 将混合物制成热饱和溶液,冷却结晶,过滤 |
| C | 除去CO2中的HCl气体 | 通过NaHCO3(aq,饱和),然后干燥 |
| D | 除去C2H5Br中的Br2 | 加入足量Na2SO3(aq),充分振荡,分液 |
实验室从海带灰中提取碘的操作过程中,仪器选用不正确的是
| A.称取3g左右的干海带——托盘天平 |
| B.灼烧干海带至完全变成灰烬——蒸发皿 |
| C.过滤煮沸后的海带灰和水的混合物——漏斗 |
| D.用四氯化碳从氧化后的海带灰浸取液中提取碘——分液漏斗 |
有 Al2(SO4)3 ,FeSO4,CuCl2, NaOH四种溶液,将其两两反应,若有一种溶液滴入另两种溶液中均产生了白色沉淀,继续滴加该溶液,原白色沉淀或消失或发生颜色变化,则可推断这一种溶液是 ( )
| A.Al2(SO4)3 | B.FeSO4 | C.BaCl2 | D.NaOH |
以下四组气体分别与对应的试纸接触,均能使试纸变蓝的是
| 选项 | 湿润的KI淀粉试纸 | 湿润的红色石蕊试纸 |
| A | NO2 | NH3 |
| B | H2S | HCl |
| C | Cl2 | CO2 |
| D | SO2 | NH3 |
下列有关实验的操作、原理和现象,不正确的是( )
| A.纸上层析法通常以滤纸作为惰性支持物。滤纸纤维上的羟基具有亲水性,它所吸附的水作固定相 |
| B.重结晶时,溶质的溶解度越大、溶液冷却速度越慢,得到的晶体颗粒越大 |
| C.往海带灰的浸泡液中加入过量的氯水,以保证I-完全氧化为I2 |
| D.将3~4个火柴头浸于水中,片刻后取少量溶液于试管中,加AgNO3溶液、稀硝酸和NaNO2溶液,若出现白色沉淀,说明含有氯元素 |
海洋中有丰富的食品、矿产、能源、药物和水产资源。下图是从海水中提取某些原料的流程图。
下列有关说法正确的是 ( )。
| A.从第③步到第⑤步的目的是浓缩、富集溴单质 |
| B.工业上通过氯碱工业制取金属钠 |
| C.第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为Na2CO3溶液―→NaOH溶液―→BaCl2溶液―→过滤后加盐酸 |
| D.第②步的反应条件是高温加热 |