题目内容
锆(Zr)主要用于核反应堆燃料棒的包层,这是因为含有1.5%Sn的锆合金具有在辐射下稳定的抗腐蚀性和机械性.以斜锆石(ZrO2)生产金属锆的生产过程示意图如下:
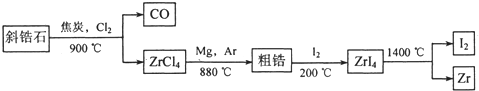
(1)写出斜锆石转化为四氯化锆的化学反应方程式:
(2)已知:
①Mg(l)+Cl2(g)=MgCl2(s);△H=akJ?mol-1
②Zr(s)+2Cl2(g)=ZrCl4(g);△H=bkJ?mol-1
则2Mg(l)+ZrCl4(g)=2MgCl2(s)+Zr(s);△H=
该反应在Ar气氛中进行的理由是 .
(3)ZrCl4是白色固体,在潮湿的空气中“冒烟”.这是因为ZrCl4易发生 反应,生成了 .
(4)2011年3月发生的日本福岛核电站爆炸,其原因是锆在高温下与水蒸气反应产生大量氢气,同时伴随着放热,最后氢气与空气混合发生爆炸.所发生的置换反应的化学方程式是 .
(5)-种新型燃料电池,一极通入空气,另一极通入甲烷;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导02-在熔融电解质中,O2-向 (填正、负)极移动.电池正极的电极反应式为 ,负极的电极反应式为 .

(1)写出斜锆石转化为四氯化锆的化学反应方程式:
(2)已知:
①Mg(l)+Cl2(g)=MgCl2(s);△H=akJ?mol-1
②Zr(s)+2Cl2(g)=ZrCl4(g);△H=bkJ?mol-1
则2Mg(l)+ZrCl4(g)=2MgCl2(s)+Zr(s);△H=
该反应在Ar气氛中进行的理由是
(3)ZrCl4是白色固体,在潮湿的空气中“冒烟”.这是因为ZrCl4易发生
(4)2011年3月发生的日本福岛核电站爆炸,其原因是锆在高温下与水蒸气反应产生大量氢气,同时伴随着放热,最后氢气与空气混合发生爆炸.所发生的置换反应的化学方程式是
(5)-种新型燃料电池,一极通入空气,另一极通入甲烷;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导02-在熔融电解质中,O2-向
分析:(1)根据流程信息,知道斜锆石在高温下,可以和焦炭以及氯气反应得到四氯化锆;
(2)根据盖斯定律来计算化学反应的焓变,并根据氩气的化学性质稳定,结合金属的化学性质来回答;
(3)根据ZrCl4易发生水解,且氯化氢极易吸收空气中的水蒸汽而出现白雾来回答;
(4)根据信息:锆在高温下与水蒸气反应产生大量氢气,结合置换反应的概念以及原子守恒来书写方程式;
(5)甲烷具有还原性,为原电池的负极,被氧化,电极反应式为CH4-8e-+4O2-═CO2+2H2O,通入空气的一极为原电池的正极,发生还原反应,电极反应式为O2+4e-=2O2-,总反应式为CH4+2O2→CO2+2H2O,以此解答该题,注意电解质和离子的定向移动方向;
(2)根据盖斯定律来计算化学反应的焓变,并根据氩气的化学性质稳定,结合金属的化学性质来回答;
(3)根据ZrCl4易发生水解,且氯化氢极易吸收空气中的水蒸汽而出现白雾来回答;
(4)根据信息:锆在高温下与水蒸气反应产生大量氢气,结合置换反应的概念以及原子守恒来书写方程式;
(5)甲烷具有还原性,为原电池的负极,被氧化,电极反应式为CH4-8e-+4O2-═CO2+2H2O,通入空气的一极为原电池的正极,发生还原反应,电极反应式为O2+4e-=2O2-,总反应式为CH4+2O2→CO2+2H2O,以此解答该题,注意电解质和离子的定向移动方向;
解答:解:(1)根据流程信息知道斜锆石在高温下,可以和焦炭以及氯气反应得到四氯化锆,发生的化学反应方程式为:ZrO2+2C+2Cl2
ZrCl4+2CO,
故答案为:ZrO2+2C+2Cl2
ZrCl4+2CO;
(2)已知:
①Mg(l)+Cl2(g)=MgCl2(s);△H=akJ?mol-1
②Zr(s)+2Cl2(g)=ZrCl4(g);△H=bkJ?mol-1
则反应2Mg(l)+ZrCl4(g)=2MgCl2(s)+Zr(s)可以通过2×①-②得到,根据盖斯定律,该化学反应的焓变为(2a-b)kJ/mol,该反应在Ar气氛中进行,这样可以防止金属和空气中的成分之间发生化学反应,故答案为:(2a-b) kJ/mol;防止金属在高温下与空气中的O2、CO2、N2反应;
(3)ZrCl4在潮湿的空气易发生水解反应,生成的氯化氢易形成盐酸液滴而导致的,故答案为:水解;盐酸酸雾;
(4)锆在高温下与水蒸气反应产生大量氢气,根据置换反应的概念,还会生成一种化合物,根据元素守恒,知道该化合物是ZrO2,即Zr+2H2O
ZrO2+2H2,
故答案为:Zr+2H2O
ZrO2+2H2;
(5)甲烷具有还原性,为原电池的负极,被氧化,电极反应式为CH4-8e-+4O2-═CO2+2H2O,通入空气的一极为原电池的正极,发生还原反应,电极反应式为O2+4e-=2O2-,在原电池中,电解质里的阴离子移向负极,故答案为:负;O2+4e-═2O2-;CH4-8e-+4O2-═CO2+2H2O.
| ||
故答案为:ZrO2+2C+2Cl2
| ||
(2)已知:
①Mg(l)+Cl2(g)=MgCl2(s);△H=akJ?mol-1
②Zr(s)+2Cl2(g)=ZrCl4(g);△H=bkJ?mol-1
则反应2Mg(l)+ZrCl4(g)=2MgCl2(s)+Zr(s)可以通过2×①-②得到,根据盖斯定律,该化学反应的焓变为(2a-b)kJ/mol,该反应在Ar气氛中进行,这样可以防止金属和空气中的成分之间发生化学反应,故答案为:(2a-b) kJ/mol;防止金属在高温下与空气中的O2、CO2、N2反应;
(3)ZrCl4在潮湿的空气易发生水解反应,生成的氯化氢易形成盐酸液滴而导致的,故答案为:水解;盐酸酸雾;
(4)锆在高温下与水蒸气反应产生大量氢气,根据置换反应的概念,还会生成一种化合物,根据元素守恒,知道该化合物是ZrO2,即Zr+2H2O
| ||
故答案为:Zr+2H2O
| ||
(5)甲烷具有还原性,为原电池的负极,被氧化,电极反应式为CH4-8e-+4O2-═CO2+2H2O,通入空气的一极为原电池的正极,发生还原反应,电极反应式为O2+4e-=2O2-,在原电池中,电解质里的阴离子移向负极,故答案为:负;O2+4e-═2O2-;CH4-8e-+4O2-═CO2+2H2O.
点评:本题考查了物质制备的流程分析产物判断,化学方程式的分析书写方法,物质性质的中和应用,原电池反应原理的应用,电极反应书写,题目难度中等.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案
相关题目
 一旦被人体吸入会引发甲状腺疾病。服用含碘元素的物质可封闭甲状腺,让放射性碘无法“入侵”。我国规定在食盐中添加碘元素的标准为20-40mg/kg,若要达到防御
一旦被人体吸入会引发甲状腺疾病。服用含碘元素的物质可封闭甲状腺,让放射性碘无法“入侵”。我国规定在食盐中添加碘元素的标准为20-40mg/kg,若要达到防御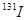 )是核裂变产物之一。
)是核裂变产物之一。
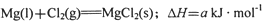

 ______________ 该反应在Ar气氛中进行的理由是______________。
______________ 该反应在Ar气氛中进行的理由是______________。  天然气。
天然气。 )是核裂变产物之一。
)是核裂变产物之一。 定在食盐中添加碘元素的标准为20-40mg/kg,若要达到防御
定在食盐中添加碘元素的标准为20-40mg/kg,若要达到防御