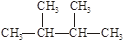题目内容
下列各组元素中,原子半径依次增大的是:( )
A. I、Br、Cl B. Al、Si、P C. O、S、Na D. C、N、B
A. I、Br、Cl B. Al、Si、P C. O、S、Na D. C、N、B
C
试题分析:A. I、Br、Cl是同一主族的元素,由于原子核外电子层数逐渐减小,所以原子半径逐渐减小。错误。B. Al、Si、P是同一周期的元素,由于原子序数逐渐增大,因此原子半径逐渐减小。错误。C. O、S是同一主族的元素,由于原子核外电子层数S比O多,所以原子半径S>O;Na、S是同一周期的元素,由于所以序数S大于Na,原子序数越大,原子半径就越小,因此原子半径Na>S。故这三种元素的原子半径关系为:O< S <Na。正确。 D. 这三种元素是同一周期的元素。由于原子序数B< C<N,原子序数越大,原子半径就越小。故原子半径关系为B>C>N。 错误。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
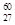 Co是r射线的放射源,关于
Co是r射线的放射源,关于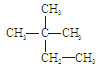 ③白磷 ④18O ⑤
③白磷 ④18O ⑤