题目内容
【题目】利用化石燃料开采、加工过程产生的H2S废气制取氢气,既价廉又环保。
(1)工业上可用组成为K2O·M2O3·2RO2·nH2O的无机材料纯化制取的氢气。
①已知元素M、R均位于元素周期表中第3周期,两种元素原子的质子数之和为27,则R的原子结构示意图为_________。
②常温下,不能与M 单质发生反应的是_________(填序号)。
a. CuSO4 溶液 b.Fe2O3c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
(2)利用H2S废气有多种方法,电化学法是其中之一。
该法制氢过程的示意图如下。反应池中反应物的流向采用气、液逆流方式,其目的是_____________;反应池中发生反应的化学方程式为_______________________________________。
反应后的溶液进入电解池,电解总反应的离子方程式为___________________________________。

【答案】 ![]() b e 增大反应物接触面积,使反应更充分 H2S+2FeCl3=2FeCl2+S↓+2HCl 2Fe2++2H+
b e 增大反应物接触面积,使反应更充分 H2S+2FeCl3=2FeCl2+S↓+2HCl 2Fe2++2H+![]() 2Fe3++H2↑
2Fe3++H2↑
【解析】试题分析:本题考查原子结构示意图的书写,Al的性质,化学方程式的书写,电解原理和电解方程式的书写。
(1)①根据“K2O·M2O3·2RO2·nH2O”知M的化合价为+3价,R的化合价为+4价;元素M、R均位于元素周期表中第3周期,两种元素原子的质子数之和为27,则M为13号元素Al,R为14号元素Si,Si的原子结构示意图为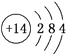 。
。
②M为Al。a,Al与CuSO4溶液发生置换反应:2Al+3CuSO4=Al2(SO4)3+3Cu,常温下能反应;b,Al与Fe2O3高温下发生铝热反应,常温下Al与Fe2O3不反应;c,常温下Al遇浓硫酸发生钝化形成致密的氧化膜;d,常温下Al与NaOH溶液反应生成NaAlO2和H2,反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑;e,常温下Al与Na2CO3固体不反应;常温下不能与Al反应的是Fe2O3、Na2CO3固体,答案选be。
(2)反应池中反应物的流向采用气、液逆流方式的目的是:增大反应物接触面积,使反应更充分。根据图示,反应池中反应为FeCl3溶液与H2S反应生成S沉淀,H2S被氧化成S,FeCl3被还原成FeCl2,反应的化学方程式为2FeCl3+H2S=2FeCl2+S↓+2HCl。反应后的溶液为FeCl2和HCl的混合液,反应后的溶液进入电解池进行电解生成Fe3+和H2,阳极反应式为Fe2+-e-=Fe3+,阴极反应式为2H++2e-=H2↑,电解总反应的离子方程式为2Fe2++2H+![]() 2Fe3++H2↑。
2Fe3++H2↑。




