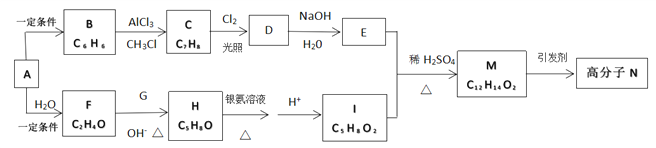
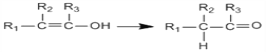
题目内容
【题目】研究PM 2.5、SO2、NOx等,对监测空气质量具有重要意义.取某样本用蒸馏水处理制成待测液,其中所含离子的化学组分及其浓度如下表:
离子 | K+ | Na+ | NH4+ | H+ | SO42﹣ | NO3﹣ | Cl﹣ |
浓度/molL﹣1 | 4×10﹣6 | 6×10﹣6 | 2×10﹣5 | a | 4×10﹣5 | 3×10﹣5 | 2×10﹣5 |
请回答下列问题:
(1)根据表中数据计算此待测液中c(H+)浓度a为 mol/L.
(2)NOx是汽车尾气中的主要污染物之一.
①汽车发动机工作时的高温会引发N2和O2反应,反应的化学方程式是 .
②NOx能形成酸雨,由NO2形成酸雨的主要反应是(写离子方程式).
(3)为减少SO2的排放,常采取的措施有:
①在燃煤中加入生石灰可以起到固硫的作用,SO2被吸收后转化成一种硫元素的最高价态的化合物,该物质的化学式是 .
②吸收烟气中的SO2 , 以下物质可作吸收剂的是(填序号);硫酸工业中的尾气SO2可以循环利用,写出SO2转化为SO3反应的化学方程式 .
a.NaOH b.H2SO4 c.NaHSO3 .
【答案】
(1)1×10﹣4
(2)N2+O2 ![]() 2NO;3NO2+H2O═2H++2NO3﹣+NO
2NO;3NO2+H2O═2H++2NO3﹣+NO
(3)CaSO4;a;2SO2+O2  2SO3
2SO3
【解析】解:(1)溶液中存在电荷守恒c(K+)+c(Na+)+c(NH4+)+c(H+)=2c(SO42﹣)+c(NO3﹣)+c(Cl﹣)结合图表数据计算得到氢离子浓度c(H+)=1×10﹣4 mol/L,
所以答案是:1×10﹣4 ;(2)①汽车发动机工作时的高温会引发N2和O2反应,反应的化学方程式是N2+O2 ![]() 2NO,
2NO,
所以答案是:N2+O2 ![]() 2NO;
2NO;
②NOx能形成酸雨,由NO2形成的酸雨为硝酸型酸雨,硝酸溶液中含有的主要离子有H+、NO3﹣ , 反应的离子方程式为;3NO2+H2O═2H++2NO3﹣+NO,
所以答案是:3NO2+H2O═2H++2NO3﹣+NO;(3)①在燃煤中加入生石灰可以起到固硫的作用,SO2被吸收后转化成一种硫元素的最高价态的化合物,是氧化钙和二氧化硫反应生成亚硫酸钙,亚硫酸钙被氧气杨宏伟硫酸钙,CaO+SO2+O2=CaSO4 , 最高价态的化合物为CaSO4 ,
所以答案是:CaSO4;②二氧化硫是酸性氧化物,
a、氢氧化钠溶液可以吸收二氧化硫,生成亚硫酸氢钠或亚硫酸钠,故a正确;
b、硫酸不能吸收二氧化硫,故b错误;
c、NaHSO3不能吸收二氧化硫,故c错误;
故选a;
硫酸工业中的尾气SO2可以循环利用,写出SO2转化为SO3反应的化学方程式为:2SO2+O2  2SO3 ,
2SO3 ,
所以答案是:a;2SO2+O2  2SO3 .
2SO3 .
【考点精析】根据题目的已知条件,利用二氧化硫的污染及治理的相关知识可以得到问题的答案,需要掌握SO2是污染大气的主要有害物质之一,直接危害是引起呼吸道疾病;形成酸雨pH<5、6,破坏农作物、森林、草原、使土壤酸性增强等等;含SO2的工业废气必须经过净化处理才能排放到空气中.