题目内容
【题目】I 在稀氨水中分别加入下列各种物质:A 氨气、 B纯水、C少量浓硫酸、 D少量氢氧化钠固体、 E少量硫酸铝固体 (用字母填空)
(1)能使c(OH-)减少,使c(NH4+)增大的是_________________。
(2)能使c(OH-)增大,使c(NH4+)减小的是_________________。
(3)能使c(OH-)和c(NH4+)都增大的是________________________。
(4)能使c(OH-)和c(NH4+)都减小的是________________________。
II 硒酸(H2SeO4)在水溶液中的电离如下:
H2SeO4===H++HSeO![]() ,HSeO
,HSeO![]()
![]() H++SeO
H++SeO![]() ,K2=1.0×10-2(25 ℃)。向H2SeO4溶液中滴加少量氨水,该反应的离子方程式为______________________。
,K2=1.0×10-2(25 ℃)。向H2SeO4溶液中滴加少量氨水,该反应的离子方程式为______________________。
III 常温下0.1 mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是________(填序号)。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-) D.![]()
若该溶液升高温度,上述4种表达式的数据增大的是_________________________。
【答案】 C、E D A B H++NH3·H2O===NH![]() +H2O A ABCD
+H2O A ABCD
【解析】I、氨水中存在NH3H2ONH4++OH-。
①加入少量硫酸或硫酸铝,可生成水或氢氧化铝沉淀,使平衡向正向移动,则c(OH-)减少、c(NH4+)增大,故答案为:CE;
②能使c(OH-)增大、c(NH4+)减少,应加入碱或水解呈碱性的物质,则NaOH溶液以及少量K2CO3符合,故答案为:D;
③通入氨气,可使c(OH-)和c(NH4+)都增大,故答案为:A;
④加水稀释时,可使c(OH-)和c(NH4+)都减少,故答案为:B;
II、氨水少量,所以硒酸(H2SeO4)的第一步完全电离产生的氢离子过量,所以反应的离子方程式为:H++NH3H2O=NH4++H2O,故答案为:H++NH3H2O=NH4++H2O;
III 、A.CH3COOH溶液加水稀释过程中,由于溶液体积增大,而醋酸的电离程度较小,则稀释后溶液中c(H+)减小,故A正确;B.稀释过程中氢离子的物质的量增大、醋酸的物质的量减小,由于在同一溶液中,溶液体积相同,则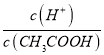 的比值增大,故B错误;C.溶液中c(H+)c(OH-)之积为水的离子积,稀释后溶液温度不变,则水的离子积不变,故C错误;D.
的比值增大,故B错误;C.溶液中c(H+)c(OH-)之积为水的离子积,稀释后溶液温度不变,则水的离子积不变,故C错误;D. 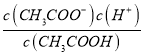 为醋酸电离平衡常数表达式,平衡常数只随温度变化,不随浓度变化,故比值不变,故D错误;故选A;若该溶液升髙温度,促进CH3COOH、H2O电离平衡正向进行,溶液中氢离子浓度、醋酸根离子浓度增大,A.氢离子浓度增大;B.
为醋酸电离平衡常数表达式,平衡常数只随温度变化,不随浓度变化,故比值不变,故D错误;故选A;若该溶液升髙温度,促进CH3COOH、H2O电离平衡正向进行,溶液中氢离子浓度、醋酸根离子浓度增大,A.氢离子浓度增大;B. 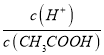 比值增大;C.溶液中c(H+)c(OH-)之积为水的离子积,升温促进水电离,离子积常数增大;D.
比值增大;C.溶液中c(H+)c(OH-)之积为水的离子积,升温促进水电离,离子积常数增大;D. 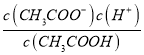 为平衡常数表达式升温促进电离平衡常数增大;上述4种表达式的数据增大的是ABCD,故答案为:A;ABCD。
为平衡常数表达式升温促进电离平衡常数增大;上述4种表达式的数据增大的是ABCD,故答案为:A;ABCD。

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案




