题目内容
在标准状况下,将CO、CO2的混合气体(密度为1.43g/L)充入盛有足量Na2O2的密闭容器里,容器的容积(不计装入固体的体积)为2.24L.然后用电火花间断引燃气体混合物,直到反应完全,求:(1)反应前CO和CO2体积比是多少?
(2)反应完全后,容器中存在的生成物是什么,物质的量各为多少?
【答案】分析:(1)混合气体的平均摩尔质量为:M=1.43g/L×22.4L/mol=32g/mol,设混合气体中CO为xmol,CO2为ymol,根据M=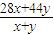 =32计算二者的物质的量之比,进而计算体积比;
=32计算二者的物质的量之比,进而计算体积比;
(2)由2CO+O2=2CO2,以及2CO2+2Na2O2=2Na2CO3+O2,二者相加可得CO+Na2O2=Na2CO3,反应后容器中存在的生成物为O2和Na2CO3,根据反应的化学方程式计算.
解答:解:(1)混合气体的平均摩尔质量为:M=1.43g/L×22.4L/mol=32g/mol,设混合气体中CO为xmol,CO2为ymol,
则有:M=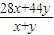 =32,
=32,
解得x:y=3:1,
根据阿伏加德罗定律可知,气体的体积之比等于物质的量之比,所以
V(CO):V(CO2)=3:1,
答:反应前CO和CO2体积比是3:1;
(2)n(CO)+n(CO2)=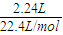 =0.1mol,
=0.1mol,
由(1)知n(CO):n(CO2)=3:1,
所以n(CO)=0.075mol,n(CO2)=0.025mol,
由2CO+O2=2CO2,以及2CO2+2Na2O2=2Na2CO3+O2,二者相加可得CO+Na2O2=Na2CO3,由方程式关系可知:
CO+Na2O2=Na2CO3
0.075mol 0.075mol
2CO2+2Na2O2=2Na2CO3+O2
0.025mol 0.025mol 0.0125mol
所以n(Na2CO3)=0.075mol+0.025mol,n(O2)=0.0125mol,
答:反应后容器中存在的生成物为O2和Na2CO3,物质的量各为n(Na2CO3)=0.1mol、n(O2)=0.0125mol.
点评:本题考查混合物的计算,题目难度中等,本题注意利用CO+Na2O2=Na2CO3,为解答该题的关键.
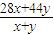 =32计算二者的物质的量之比,进而计算体积比;
=32计算二者的物质的量之比,进而计算体积比;(2)由2CO+O2=2CO2,以及2CO2+2Na2O2=2Na2CO3+O2,二者相加可得CO+Na2O2=Na2CO3,反应后容器中存在的生成物为O2和Na2CO3,根据反应的化学方程式计算.
解答:解:(1)混合气体的平均摩尔质量为:M=1.43g/L×22.4L/mol=32g/mol,设混合气体中CO为xmol,CO2为ymol,
则有:M=
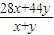 =32,
=32,解得x:y=3:1,
根据阿伏加德罗定律可知,气体的体积之比等于物质的量之比,所以
V(CO):V(CO2)=3:1,
答:反应前CO和CO2体积比是3:1;
(2)n(CO)+n(CO2)=
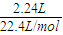 =0.1mol,
=0.1mol,由(1)知n(CO):n(CO2)=3:1,
所以n(CO)=0.075mol,n(CO2)=0.025mol,
由2CO+O2=2CO2,以及2CO2+2Na2O2=2Na2CO3+O2,二者相加可得CO+Na2O2=Na2CO3,由方程式关系可知:
CO+Na2O2=Na2CO3
0.075mol 0.075mol
2CO2+2Na2O2=2Na2CO3+O2
0.025mol 0.025mol 0.0125mol
所以n(Na2CO3)=0.075mol+0.025mol,n(O2)=0.0125mol,
答:反应后容器中存在的生成物为O2和Na2CO3,物质的量各为n(Na2CO3)=0.1mol、n(O2)=0.0125mol.
点评:本题考查混合物的计算,题目难度中等,本题注意利用CO+Na2O2=Na2CO3,为解答该题的关键.

练习册系列答案
相关题目