题目内容
9.某元素的同位素${\;}_{Z}^{A}$X,它的氯化物XCl20.95g溶于水制成溶液后,加入1mol/LAgNO3溶液20mL恰好完全反应.若这种同位素原子核内中子数与质子数相等,求:(1)X的质子数和质量数;
(2)写出X元素的名称和元素符号,并画出原子结构示意图.
分析 根据Cl-+Ag+═AgCl↓计算XCl2的物质的量,再由M=$\frac{m}{M}$计算其摩尔质量,摩尔质量与相对分子质量的数值相等,原子的质量数为原子的近似相对原子质量.
解答 解:(1)由Cl-+Ag+═AgCl↓可知,n(Cl-)=n(Ag+)=0.02L×1mol/L=0.02mol,
n(XCl2)=$\frac{1}{2}$n(Cl-)=$\frac{1}{2}$×0.02mol=0.01mol,
则M(XCl2)=$\frac{0.95g}{0.01mol}$=95g/mol,
所以XCl2相对分子质量为95,所以X的相对原子质量=95-35.5×2=24,即X的质量数为24,那么X为镁,质子数为12,
答:X的质子数为12,质量数24;
(2)X为镁元素,元素符号为Mg,Mg有3个电子层,最外层电子数是2,原子结构示意图为: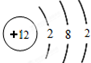 ,故答案为:镁;Mg;
,故答案为:镁;Mg;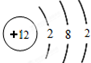 .
.
点评 本题考查元素的推断和化学计算,题目难度不大,解答本题的关键是根据反应的关系式计算M的摩尔质量,难度不大.

练习册系列答案
相关题目
19.常温下,将0.02mol•L-1的Ba(OH)2溶液 100mL 和0.02mol•L-1NaHSO4溶液 100mL混合,若忽略溶液体积变化,则混合后的溶液( )
| A. | pH=12 | |
| B. | pH=2 | |
| C. | 由水电离产生的[H+]=1.0×10-2mol•L-1 | |
| D. | 溶质的物质的量浓度为0.01 mol•L-1 |
4.同温同压下,相同体积的氦气(${\;}_{2}^{4}$He)和氘气(${\;}_{1}^{2}$H2)不相等的是( )
| A. | 分子数 | B. | 原子数 | C. | 中子数 | D. | 电子数 |
14.欲除去氯气中的少量氯化氢气体,最好选用( )
| A. | 水 | B. | NaOH溶液 | C. | 饱和食盐水 | D. | 石灰水 |
19.下列物质中与钠、苛性钠、小苏打均能发生反应的是( )
| A. | 乙醇 | B. | 苯酚 | C. | 乙酸 | D. | 乙醛 |