题目内容
理论上,SO2能发生类似CO2与澄清石灰水作用的反应,但在通常实验中,将SO2通入澄清石灰水却没有看到类似CO2那样先浑浊后澄清的现象.针对这一问题,研究性学习小组开展了探究性实验.

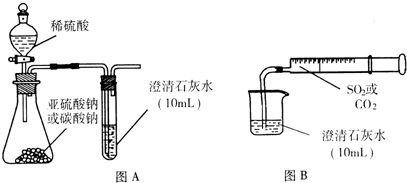
I.用图A所示的装置来分别做CO2、SO2与澄清石灰水的反应实验,结果通人CO2可看到先浑浊后澄清的现象,但通入SO2没看到浑浊现象.
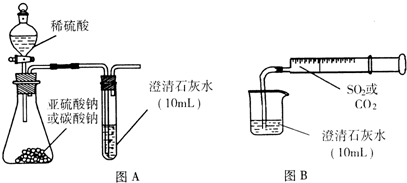
Ⅱ.用图B的装置,将气体收集在注射器里,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,无论CO2还是SO2都能看到“先变浑再澄清”的现象.当以相同速率分别通人CO2或SO2,通入SO2产生现象明显比通入CO2产生现象快.
回答下列问题:
(1)通过上述I、Ⅱ实验,可以确定,将足量SO2缓慢通人澄清石灰水,依次发生的反应有:(用离子方程式表示)______;______.
(2)实验I中,通人SO2不能出现浑浊的原因可能是:______.
(3)实验Ⅱ中,同速率分别通入CO2或SO2,SO2产生现象比CO2快的相关因素有______.
①SO2在水中溶解度比CO2大.
②相同状态下,SO2的密度比CO2的密度大.
③亚硫酸酸性比碳酸强,在同温度、同体积的溶液中,l mol亚硫酸电离产生的H+离子浓度大于l mol碳酸电离产生的H+离子浓度.
④SO2有毒和刺激性气味,CO2无毒和无刺激性气味.
⑤相同条件下,1mol SO2与足量石灰水反应生成CaSO3的速率大于1mol CO2与足量石灰水反应生成CaCO3的速率.
⑥相同条件下,1molCaSO3被1mol SO2(形成的H+离子)溶解形成可溶性Ca(HSO3)2的速率大于1molCaCO3被1molCO2(形成的H+离子)溶解形成可溶性Ca(HCO3)2的速率.
解:(1)二氧化碳与氢氧化钙溶液反应生成碳酸钙和水、碳酸钙与水与二氧化碳反应生成碳酸氢钙,而SO2和CO2均属于非金属氧化物,某些性质相似,因此二氧化硫通入澄清石灰水生成亚硫酸钙沉淀和水,反应的化学方程式为SO2+Ca(OH)2═CaSO3↓+H2O,继续通沉淀溶解反应方程式为:CaSO3+H2O+SO2=Ca(HSO3)2,所以离子反应方程式为SO2+Ca2++2OH-═CaSO3↓+H2O;CaSO3+H2O+SO2=Ca2++2HSO3-,
故答案为:SO2+Ca2++2OH-═CaSO3↓+H2O;CaSO3+H2O+SO2=Ca2++2HSO3-;
(2)二氧化硫与澄清的石灰水反应,如果二氧化硫过量,会发生CaSO3+H2O+SO2=Ca(HSO3)2,亚硫酸氢钙易溶于水,所以,当实验操作通入二氧化硫较快较多,澄清的石灰水相对比较少,两者反应时直接生成了易溶于水的酸式盐,而看不到沉淀,
故答案为:澄清的石灰水比较少,通入二氧化硫较快较多,两者反应时直接生成了易溶于水的酸式盐,而看不到沉淀;
(3)①1体积水中溶解二氧化硫为40体积,1体积水中溶解二氧化碳为2体积,所以,SO2在水中溶解度比CO2大,在溶液中,参加反应的二氧化硫比二氧化碳多,故①正确;
②密度大小与在溶液中的气体的物质的量的多少无关,所以相同状态下,SO2的密度比CO2的密度大与反应现象无关,故②错误;
③二氧化硫与水反应生成亚硫酸,二氧化碳与水反应生成碳酸,亚硫酸酸性比碳酸强,在同温度、同体积的溶液中,l mol亚硫酸电离产生的H+离子浓度大于l mol碳酸电离产生的H+离子浓度,与碱反应,前者电离出的氢离子多,反应快,故③正确;
④二氧化硫气体与二氧化碳的气体与碱反应,本质为酸性气体和碱反应,其气味和毒性与碱反应快慢无关,故④错误;
⑤相同条件下,相同的物质的量与碱反应,反应快,能说明SO2产生现象比CO2快,所以,1mol SO2与足量石灰水反应生成CaSO3的速率大于1mol CO2与足量石灰水反应生成CaCO3的速率正确,故⑤正确;
⑥相同条件下,相同的物质的量的气体与沉淀,溶解得快,说明SO2产生现象比CO2快,所以,1molCaSO3被1mol SO2(形成的H+离子)溶解形成可溶性Ca(HSO3)2的速率大于1molCaCO3被1molCO2(形成的H+离子)溶解形成可溶性Ca(HCO3)2的速率,正确,故⑥正确;
故答案为:①③⑤⑥.
分析:(1)模拟二氧化碳与澄清石灰水、水反应的化学方程式,利用二氧化碳、二氧化硫化学性质相似的信息,写出二氧化硫与氢氧化钙、水反应的化学方程式,据方程式再书写离子反应方程式;
(2)根据反应操作的可能情况和亚硫酸氢钙的溶解性解答;
(3)①气体溶解度大,在溶液中的气体多,参加反应的物质多;
②相同状态下,密度大小与参加反应的物质多少无关;
③亚硫酸酸性比碳酸强,在同温度、同体积的溶液中,电离产生的H+离子浓度大;
④毒性和气体气味与反应快慢无关;
⑤相同条件下,同物质的量的SO2与CO2与足量石灰水反应能比较反应的速率;
⑥相同条件下,同物质的量的SO2与CO2与各自的沉淀溶解速率,能比较SO2产生现象比CO2快.
点评:本题主要考查了二氧化硫的性质,解答须掌握二氧化硫与氢氧化钙的反应的原理,题目难度中等.
故答案为:SO2+Ca2++2OH-═CaSO3↓+H2O;CaSO3+H2O+SO2=Ca2++2HSO3-;
(2)二氧化硫与澄清的石灰水反应,如果二氧化硫过量,会发生CaSO3+H2O+SO2=Ca(HSO3)2,亚硫酸氢钙易溶于水,所以,当实验操作通入二氧化硫较快较多,澄清的石灰水相对比较少,两者反应时直接生成了易溶于水的酸式盐,而看不到沉淀,
故答案为:澄清的石灰水比较少,通入二氧化硫较快较多,两者反应时直接生成了易溶于水的酸式盐,而看不到沉淀;
(3)①1体积水中溶解二氧化硫为40体积,1体积水中溶解二氧化碳为2体积,所以,SO2在水中溶解度比CO2大,在溶液中,参加反应的二氧化硫比二氧化碳多,故①正确;
②密度大小与在溶液中的气体的物质的量的多少无关,所以相同状态下,SO2的密度比CO2的密度大与反应现象无关,故②错误;
③二氧化硫与水反应生成亚硫酸,二氧化碳与水反应生成碳酸,亚硫酸酸性比碳酸强,在同温度、同体积的溶液中,l mol亚硫酸电离产生的H+离子浓度大于l mol碳酸电离产生的H+离子浓度,与碱反应,前者电离出的氢离子多,反应快,故③正确;
④二氧化硫气体与二氧化碳的气体与碱反应,本质为酸性气体和碱反应,其气味和毒性与碱反应快慢无关,故④错误;
⑤相同条件下,相同的物质的量与碱反应,反应快,能说明SO2产生现象比CO2快,所以,1mol SO2与足量石灰水反应生成CaSO3的速率大于1mol CO2与足量石灰水反应生成CaCO3的速率正确,故⑤正确;
⑥相同条件下,相同的物质的量的气体与沉淀,溶解得快,说明SO2产生现象比CO2快,所以,1molCaSO3被1mol SO2(形成的H+离子)溶解形成可溶性Ca(HSO3)2的速率大于1molCaCO3被1molCO2(形成的H+离子)溶解形成可溶性Ca(HCO3)2的速率,正确,故⑥正确;
故答案为:①③⑤⑥.
分析:(1)模拟二氧化碳与澄清石灰水、水反应的化学方程式,利用二氧化碳、二氧化硫化学性质相似的信息,写出二氧化硫与氢氧化钙、水反应的化学方程式,据方程式再书写离子反应方程式;
(2)根据反应操作的可能情况和亚硫酸氢钙的溶解性解答;
(3)①气体溶解度大,在溶液中的气体多,参加反应的物质多;
②相同状态下,密度大小与参加反应的物质多少无关;
③亚硫酸酸性比碳酸强,在同温度、同体积的溶液中,电离产生的H+离子浓度大;
④毒性和气体气味与反应快慢无关;
⑤相同条件下,同物质的量的SO2与CO2与足量石灰水反应能比较反应的速率;
⑥相同条件下,同物质的量的SO2与CO2与各自的沉淀溶解速率,能比较SO2产生现象比CO2快.
点评:本题主要考查了二氧化硫的性质,解答须掌握二氧化硫与氢氧化钙的反应的原理,题目难度中等.

练习册系列答案
相关题目