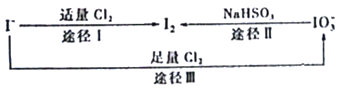
题目内容
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A. 无色溶液中:Ca2+、Cu2+、Br-、Cl- 、
B. c(ClO-)=1mol·L-1的溶液中:Fe2+、Al3+、Cl-、I-
C. 能使酚酞变红的溶液中:K+、Na+、SiO32-、SO42-
D. ![]() =0.1mol·L-1的溶液中:NH4+、Mg2+、SO42-、CH3COO-
=0.1mol·L-1的溶液中:NH4+、Mg2+、SO42-、CH3COO-
【答案】C
【解析】
根据题干分析溶液中还可能存在哪些离子,再进一步分析给出的离子是否能大量存在。
Cu2+有颜色,不能大量存在,故A错误;
Fe2+、ClO-之间发生氧化还原反应,故B错误;
使酚酞变红,溶液呈碱性,溶液中含有OH-,与 K+、Na+、SiO32-、SO42-均不反应,可以大量共存,故C正确;
![]() =0.1mol·L-1的溶液中,因为Kw=c(OH+)·c(H+),溶液呈酸性,CH3COO-不能大量存在,故D错误。
=0.1mol·L-1的溶液中,因为Kw=c(OH+)·c(H+),溶液呈酸性,CH3COO-不能大量存在,故D错误。
故选C。

【题目】一定温度下,向1L密闭容器中加入1mol HI(g),发生反应2HI(g)![]() H2(g)+I2(g)△H > 0,H2物质的量随时间的变化如图所示。
H2(g)+I2(g)△H > 0,H2物质的量随时间的变化如图所示。
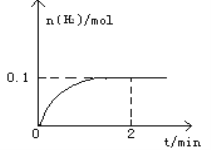
(1)2 min时HI的转化率a(HI)=____________________。该温度下,H2(g)+I2(g)![]() 2HI(g)的平衡常数K=________________。
2HI(g)的平衡常数K=________________。
(2)下列哪种情况能说明该反应已经达到平衡状态(___________)
A.气体的密度不再变化了
B.气体的颜色不再变化了
C.气体的总压强不再变化了
D.相同时间内消耗氢气的质量和生成碘的质量相等
E.单位时间内消耗氢气和消耗碘化氢的物质的量相等
F.氢气的质量分数不变了
(3)在恒容绝热(不与外界交换能量)条件下进行2A(g)+B(g) ![]() 2C(g)+D(s)反应,该反应的平衡常数的表达式K=____________________,按下表数据投料:
2C(g)+D(s)反应,该反应的平衡常数的表达式K=____________________,按下表数据投料:
物质 | A | B | C | D |
起始投料/mol | 2 | 1 | 2 | 0 |
反应达到平衡状态,测得体系压强升高。该反应△H____0(填“>”、“<” 或者“=”),简述该反应的平衡常数与温度的变化关系:__________________________________________________。
(4)该反应如果把D的物质的量增大一倍,逆反应速率________(填“增大”、“减小” 或者“不变”)。